Michael Palmer, MD y Sucharit Bhakdi, MD
Este documento fue escrito para responder a tres preguntas que nos hizo un abogado que cuestiona las aprobaciones y los mandatos de la vacuna COVID-19 en su país de origen. Las respuestas también pueden ser de interés para los lectores de este sitio web.
1. ¿Qué evidencia está disponible actualmente para mostrar que las partículas de la vacuna de ARNm cruzan la barrera hematoencefálica?
Esta pregunta no ha sido estudiada rigurosamente en humanos o animales. A continuación se presenta una descripción general de la limitada evidencia disponible.
1.1. Pruebas en animales con vacunas modelo
Tanto Pfizer [ 1 ] como Moderna [ 2 ] han realizado estudios en animales con vacunas modelo que contenían los mismos lípidos que las respectivas vacunas contra la COVID-19, pero diferentes ARNm. En ambos casos, también se encontraron componentes de estas vacunas modelo en el tejido cerebral; Pfizer detectó el componente lipídico y Moderna detectó el ARNm. En ambos casos, las concentraciones en el tejido cerebral fueron significativamente más bajas que las de la sangre. Sin embargo, como quedará claro a continuación, estos hallazgos no significan que estas vacunas no dañarán el cerebro.
1.2. Sobre el mecanismo de transporte a través de la barrera hematoencefálica
In vivo, las nanopartículas lipídicas del tipo utilizado en las vacunas de Pfizer y Moderna adquirirán una “corona biomolecular”, es decir, una capa exterior formada por las propias proteínas del cuerpo. Con este recubrimiento, se comportan de manera similar a las partículas transportadoras de grasa naturales del cuerpo, las lipoproteínas . La captación celular de las nanopartículas lipídicas y su transporte a través de la barrera hematoencefálica están mediados en particular por el recubrimiento con las proteínas ApoB y ApoE [ 3 , 4 ] , que también cumplen el mismo propósito con las lipoproteínas del propio cuerpo.
1.3. ¿Puede la proteína espiga afectar el transporte a través de la barrera hematoencefálica?
Si bien las nanopartículas de lípidos son importantes, no se debe pasar por alto un posible papel del ARNm contenido en la vacuna. Se sabe que la proteína espiga del SARS-CoV-2 puede afectar la función de la barrera hematoencefálica [ 5 – 8 ]. Muy posiblemente, las partículas de la vacuna pueden ser absorbidas inicialmente por células fuera del cerebro, que luego producen y liberan proteína de punta en el torrente sanguíneo. Esta proteína de pico circulante podría actuar sobre la barrera hematoencefálica y facilitar el paso de más partículas de vacuna al tejido cerebral. Por lo tanto, habría sido muy importante realizar estos estudios en animales con las vacunas COVID-19 reales en lugar de solo con vacunas modelo. Esto no habría sido particularmente difícil desde un punto de vista técnico. Con toda probabilidad, los fabricantes realizaron estos estudios, pero optaron por mantener los resultados en el gabinete de veneno, o se saltearon deliberadamente estos experimentos para evitar el riesgo de obtener resultados desfavorables para ellos.
1.4. Barrera hematoencefálica e inyecciones de refuerzo
La barrera hematoencefálica consta de dos capas de células: el endotelio de los pequeños vasos sanguíneos forma la capa interna y las células gliales del tejido cerebral circundante forman la capa externa. Es bien sabido que la barrera hematoencefálica se vuelve permeable durante la inflamación. Hasta que se demuestre lo contrario, se debe suponer que esto también se aplica a la inflamación de los vasos sanguíneos (vasculitis) en el cerebro que fue inducida por las vacunas de ARNm; que estas vacunas de hecho causan varias formas de vasculitis ahora está ampliamente documentado en la literatura [ 9 – 14 ] .
En este contexto, parece probable que la primera inyección de una vacuna de ARNm provoque inflamación de los vasos cerebrales, lo que ablandaría la barrera hematoencefálica. Las partículas de vacuna aplicadas con la segunda inyección podrían pasar sin obstáculos al tejido cerebral. Por lo tanto, no es suficiente investigar el transporte de vacunas de ARNm a través de la barrera hematoencefálica solo después de una sola inyección, como hicieron Pfizer y Moderna en sus experimentos con animales; en cambio, el transporte también debería haberse medido después de inyecciones repetidas.
1.5. Inyección intravenosa accidental de las vacunas
Las vacunas COVID-19 se inyectan por vía intramuscular. Con esta forma de aplicación se pretende aplicar el fármaco o vacuna en cuestión en el espacio extracelular fuera del torrente sanguíneo, para que permanezca en los tejidos, al menos inicialmente; a partir de ahí, puede llegar al torrente sanguíneo solo lentamente o no llegar en absoluto. Los estudios en animales de los fabricantes citados anteriormente encontraron que, de hecho, una gran proporción de las vacunas modelo inyectadas por vía intramuscular permanecieron en el tejido muscular. Las evaluaciones de riesgo publicadas por las diversas agencias reguladoras nacionales e internacionales asumen que este siempre será el caso.
Sin embargo, todo médico debe saber que incluso con una técnica cuidadosa, es decir, con una aspiración previa [ 15 – 17 ] , la inyección puede ocurrir accidentalmente en el torrente sanguíneo. En estudios con animales, se ha observado que la miocarditis causada por vacunas de ARNm es más grave después de la inyección intravenosa que después de la intramuscular [ 18 ] . Se debe suponer que ocurre lo mismo con los humanos y con el daño a otros órganos, incluido el cerebro.
1.6. Conclusión
En resumen, los datos disponibles no son suficientes para una estimación cuantitativa fiable del transporte de las vacunas de ARNm a través de la barrera hematoencefálica, pero prueban cualitativamente, no obstante, que las nanopartículas lipídicas entran en el cerebro. Las evaluaciones optimistas de las autoridades reguladoras sobre este tema no tienen en cuenta los riesgos graves y los factores de confusión importantes y, por lo tanto, no son realistas.
2. ¿Cuánto tiempo pueden permanecer las nanopartículas de la vacuna en el cerebro?
En primer lugar, se debe aclarar que las nanopartículas como tales probablemente no duran mucho en ninguna parte del cuerpo: poco después de su absorción en una célula, los lípidos se separarán del ARN. Solo después de que el ARN se haya liberado de esta manera, puede iniciar la síntesis de la proteína de pico dentro de la célula. A partir de ese momento, lo más probable es que el período de tiempo de la actividad biológica se decida por la estabilidad del ARN, aunque los componentes lipídicos también pueden contribuir a la toxicidad de la vacuna de ARNm.
Al igual que con la cuestión del transporte al cerebro, los fabricantes no han proporcionado datos suficientes y fiables sobre la persistencia de los ARNm de la vacuna en el tejido cerebral. El documento de EMA sobre Moderna nuevamente solo contiene datos sobre la vacuna modelo, no sobre la vacuna COVID real. Según se informa, tres días después de la inyección, el ARNm de la vacuna modelo permaneció detectable solo en el tejido muscular, los ganglios linfáticos y el bazo. Pfizer no informó mediciones directas de ARN, sino solo datos sobre la actividad de la proteína codificada por la vacuna modelo (luciferasa). Esta actividad decayó con una vida media de aproximadamente un día [ 1 ] . Sin embargo, no se realizaron mediciones en los cerebros de los animales.
En ambos casos, sigue siendo incierto en qué medida estos hallazgos de los experimentos con animales se aplican a la vida útil, dentro del cerebro humano, del ARNm que codifica la proteína de punta del SARS-CoV-2. Sin embargo, veremos en la siguiente sección que hay razones para creer que la expresión de la proteína de pico en el cerebro humano, inducida por la vacunación, puede durar mucho más de lo que sugieren estos datos en animales.
3. ¿Qué daño pueden causar las nanopartículas de vacunas en el cerebro?
Debemos señalar desde el principio que, cuando se trata de daño al cerebro, la barrera hematoencefálica es menos crucial de lo que se podría suponer; las razones se aclararán a continuación.
3.1. Ataque
Ahora está claro que los eventos adversos causados por las vacunas COVID modificadas genéticamente (basadas tanto en ARNm como en adenovirus) comienzan muy a menudo con daño a los vasos sanguíneos (ver Figura 1 ) . La lesión vascular conduce entonces a la formación de coágulos de sangre; los tejidos y órganos que dependen de estos vasos obstruidos para su suministro de sangre se dañarán o incluso perecerán. Los accidentes cerebrovasculares y los ataques cardíacos son ejemplos sencillos y prácticamente importantes de este mecanismo patogénico [ 19 – 21 ] . Otra variación es la hemorragia que sigue a la ruptura de los vasos sujetos a la inflamación inducida por la vacuna [ 22 – 24 ]. Para estas formas de lesión, es suficiente que las partículas de vacuna sean absorbidas desde la sangre circulante hacia las células de las paredes de los vasos sanguíneos. Estas células luego expresarán la proteína espiga, un antígeno extraño, y por lo tanto incurrirán en la ira del sistema inmunitario, que luego causará el daño real. Tenga en cuenta, sin embargo, que en este escenario las partículas no necesitan cruzar ninguna barrera anatómica importante; y en particular, no es necesario que crucen la barrera hematoencefálica para dañar los vasos cerebrales y provocar un accidente cerebrovascular.
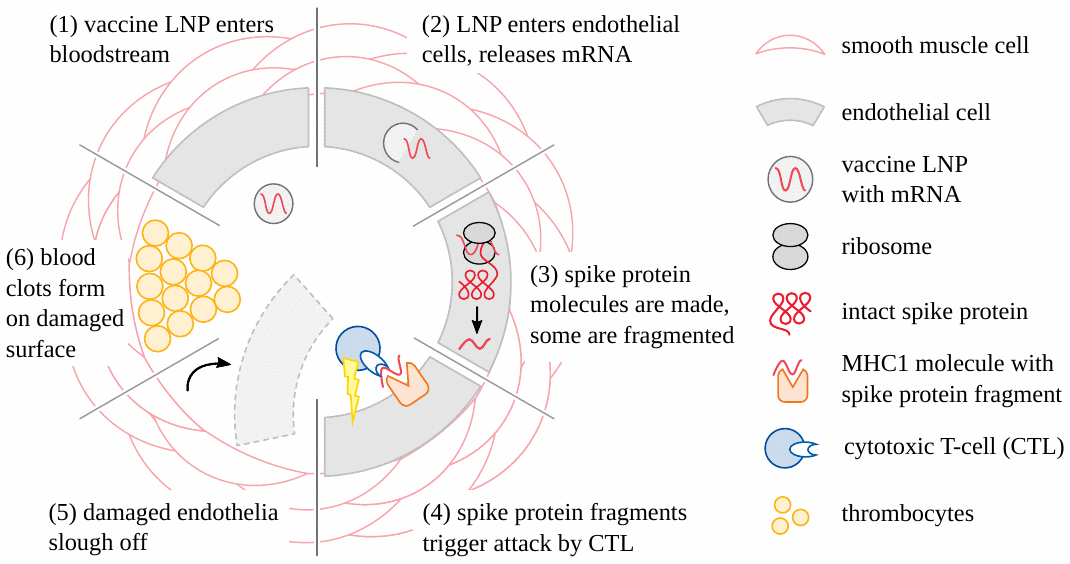
3.2. Inflamación del cerebro y la médula espinal
Además del accidente cerebrovascular, las vacunas de ARNm también han causado muchos casos de encefalitis y mielitis, es decir, inflamación del cerebro y de la médula espinal, respectivamente, ya veces también de ambos a la vez (encefalomielitis). Los mecanismos patogénicos son los mismos con las tres enfermedades; en aras de la simplicidad, utilizaremos sólo el término ‘encefalitis’ a continuación.
3.2.1. Encefalitis debida a una reacción inmunitaria contra la proteína espiga
Debe esperarse que este mecanismo patogénico opere desde los primeros principios de la inmunología. ¿Cómo podría probarse en un caso dado de encefalitis? Los siguientes criterios harían que tal diagnóstico fuera al menos altamente probable:
- aparición dentro de los días a unas pocas semanas de la inyección de la vacuna;
- detección de linfocitos y otras células inflamatorias dentro del tejido cerebral;
- detección de proteína espiga en los focos de inflamación.
Cabe señalar que los criterios 2 y 3 solo pueden cumplirse mediante exámenes histopatológicos; con el encéfalo, por lo general sólo se realizan después de la autopsia, ya que las biopsias de este órgano son particularmente precarias.
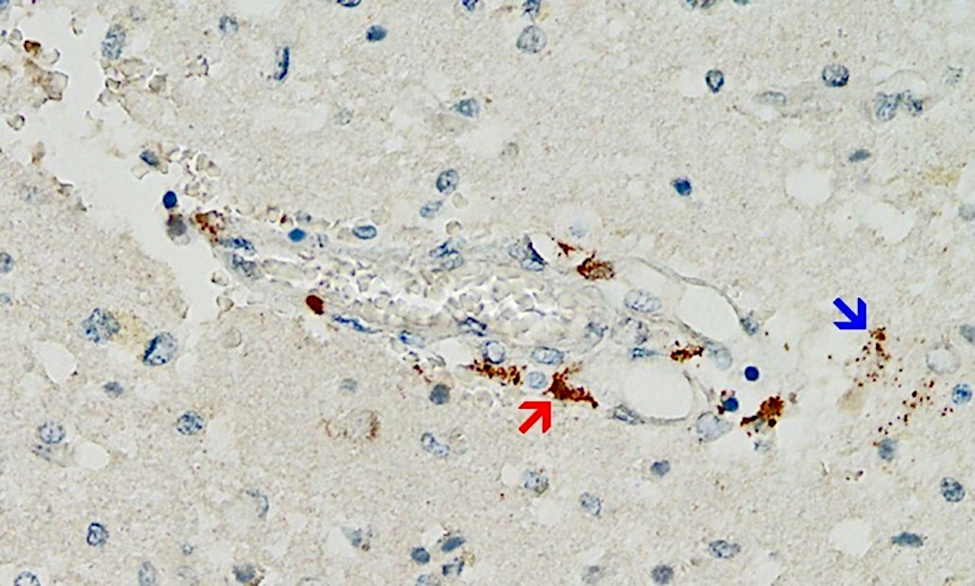
Aunque es probable que este mecanismo sea de gran importancia, la evidencia de respaldo hasta el momento es escasa, simplemente porque los patólogos no la han estado buscando. Sin embargo, acaba de publicarse un primer informe de caso que cumple con todos los criterios anteriores [ 25 ] (ver Figura 2 ). Este estudio muy meticuloso también descartó que la expresión detectada de la proteína espiga fuera causada por la infección con el virus en sí y no por la vacunación.
El paciente en cuestión había recibido inicialmente una sola inyección de la vacuna basada en adenovirus de AstraZeneca, seguida de dos inyecciones de la vacuna de ARNm de Pfizer. La última inyección se había administrado tres semanas antes del momento de la muerte. Se detectó una marcada expresión de la proteína espiga en los capilares cerebrales y también en las células gliales del tejido cerebral, muy probablemente causada por la dosis más reciente de la vacuna de ARNm. Por lo tanto, se debe suponer que la proteína del pico sobrevive durante al menos varias semanas después de la aplicación de las vacunas de ARNm, y lo más probable es que también se sintetice continuamente durante este tiempo. Este hallazgo se hace eco de estudios previos en varios tejidos además del cerebro y en la sangre [ 26 – 29 ]. La expresión de la proteína espiga en las células gliales también muestra inequívocamente que cualquiera de las vacunas o ambas pueden atravesar la barrera hematoencefálica.
3.2.2. Encefalitis autoinmune
En este mecanismo patogénico, la conexión con la vacunación es indirecta: la vacuna primero desencadena una inflamación, que puede que ni siquiera tenga que afectar directamente al cerebro; y en el contexto de esta inflamación se activa una respuesta inmunitaria no solo contra la proteína espiga sino también contra una o más proteínas propias del organismo u otras biomoléculas (autoantígenos). Entonces, el sistema inmunitario puede atacar estos mismos autoantígenos dentro de los órganos diana inicialmente no afectados, incluido el cerebro, y desencadenar allí también una inflamación.
Los síntomas clínicos, y también los hallazgos de la autopsia cuando se usan métodos de rutina, probablemente serán muy similares a los de una reacción inmunitaria al pico. Por lo tanto, ¿cómo se podría decidir si la encefalitis es desencadenada por la proteína espiga o por un autoantígeno? En una encefalitis autoinmune verdadera, uno debe esperar los siguientes hallazgos:
- los autoanticuerpos contra los autoantígenos en cuestión deben ser detectables en muestras de sangre;
- la proteína espiga no debería ser detectable en las lesiones inflamatorias;
- la conexión temporal con la vacunación podría ser menos estrecha, porque los autoantígenos se producen en el cuerpo perpetuamente.
Jarius et al. [ 30 ] informó un caso de encefalitis con autoanticuerpos positivos en un paciente que había recibido inicialmente dos dosis de la vacuna basada en adenovirus de AstraZeneca, seguidas de una dosis de la vacuna de ARNm de Pfizer. En este paciente, una proteína expresada en el cerebro, la glicoproteína de oligodendrocitos de mielina (MOG), era el autoantígeno. Estos autores también proporcionaron una descripción general de otros veinte casos informados previamente en la literatura. En tres de estos casos se había utilizado una vacuna de ARNm, mientras que los diecisiete casos restantes estaban asociados a la vacuna de AstraZeneca. Dado que ninguno de estos casos fue fatal, no se obtuvo evidencia histopatológica positiva o negativa de expresión de proteína de punta.
Asioli et al. [ 31 ] informó de cuatro casos de encefalitis en los que se detectaron autoanticuerpos contra la proteína LGI1. Tres de estos casos, todos de la misma ciudad (Bolonia), ocurrieron después de la inyección de vacunas de ARNm. Un caso particularmente llamativo fue informado por Poli et al. [ 32 ] . Este paciente desarrolló tres enfermedades autoinmunes diferentes simultáneamente: encefalitis desmielinizante, miastenia y tiroiditis. Sin embargo, no se detectaron autoanticuerpos específicos que pudieran explicar la encefalitis en este caso.
3.2.3. Encefalitis autoinmune con anticuerpos negativos
En varios informes de casos de encefalitis después de la inyección de vacunas de ARNm, se hizo el diagnóstico de «encefalitis autoinmune con anticuerpos negativos» ( [ 33 – 35 ] . Sin duda, es razonable suponer que en muchos de estos casos un autoantígeno no identificado puede haber sido la causa. por otro lado, sin histopatología, a menudo será imposible decidir si un caso dado de encefalitis fue causado por una reacción inmunitaria contra un autoantígeno desconocido o contra la proteína espiga.
3.3. Conclusión
Se han informado numerosos casos de encefalitis, mielitis y encefalomielitis después del uso de vacunas de ARNm y también de vacunas basadas en adenovirus. Tanto las reacciones autoinmunes como una reacción inmune contra la proteína espiga han demostrado ser causales en casos específicos. La proporción respectiva de cada forma entre el número total de todos los casos clínicos de encefalitis no puede determinarse sobre la base de la evidencia actualmente disponible.
4. Resumen
Existen numerosos informes de casos de trastornos del sistema nervioso central tras el uso de vacunas de ARNm contra COVID-19. Estos trastornos incluyen apoplejía, hemorragia cerebral y encefalitis. No es necesario que las vacunas atraviesen la barrera hematoencefálica para dañar el cerebro; sin embargo, esto debe considerarse posible, especialmente después de inyecciones repetidas o inyecciones intravenosas accidentales, y es probable que agrave el curso clínico de la encefalitis.
Referencias
- (2020) Vacuna de ARNm contra el SARS-CoV-2 (BNT162, PF-07302048) 2.6.4 Resumen del estudio farmacocinético [traducción al inglés] .
- (2021) Informe de evaluación de la EMA: COVID-19 Vaccine Moderna .
- (2002) Transporte mediado por apolipoproteínas de fármacos unidos a nanopartículas a través de la barrera hematoencefálica . Revista de focalización de drogas 10: 317-25
- (2020) La corona biomolecular de nanopartículas lipídicas para la terapia génica . bioconjugador química 31:2046-2059
- (2020) La proteína de pico SARS-CoV-2 altera la función de barrera en modelos in vitro microfluídicos 2D estáticos y 3D de la barrera hematoencefálica humana . Neurobiol. Dis. 146:105131
- (2021) La proteína Spike del SARS-CoV-2 interrumpe la integridad de la barrera hematoencefálica a través de la activación de RhoA . J. Neuroinmune Pharmacol. 16:722-728
- (2022) Penetración de la proteína Spike del SARS-CoV-2 a través de la barrera hematoencefálica, según lo revelado por una combinación de un sistema modelo de cultivo de células humanas y biodetección óptica . Biomedicinas 10 (preimpresión)
- (2021) La proteína S1 del SARS-CoV-2 cruza la barrera hematoencefálica en ratones . Nat. Neurosci. 24:368-378
- (2022) Vasculitis necrotizante de novo y recidivante después de la vacunación con COVID-19 . clin. Riñón J. 15:560-563
- (2022) Vasculitis leucocitoclástica (vasculitis cutánea de vasos pequeños) después de la vacunación con COVID-19 . J. Autoinmune. 127:102783
- (2022) Arteritis de células gigantes que se presenta con tos crónica y dolor de cabeza después de la vacunación con ARNm de BNT162b2 contra la COVID-19 . QJM (preimpresión)
- (2022) Informe de un caso de vasculitis asociada a MPO-ANCA después de la vacunación de refuerzo heterólogo mRNA1273 COVID-19 . J. Korean Med. ciencia 37: e204
- (2022) Vasculitis IgA comprobada por biopsia renal de nueva aparición después de recibir la vacuna mRNA-1273 COVID-19: informe de caso . Informe de caso CEN (preimpresión)
- (2022) Vasculitis sistémica después de la vacunación con ARNm de SARS-CoV-2 demostrada en FDG PET/CT . clin. Núcleo Medicina. 47:e403-e405
- (2022) ¿Aspirar o no aspirar? Consideraciones para las vacunas COVID-19 . Farmacol. Rep. (preimpresión)
- (1999) Técnicas de inyección seguras . enfermeras Pararse. 13:47-53; prueba 54
- (1988) Lesiones intravasculares por penicilina intramuscular . clin. pediatra Fila 27:85-90
- (2021) La inyección intravenosa de la vacuna de ARNm de COVID-19 puede inducir miopericarditis aguda en un modelo de ratón . clin. Infectar. Dis. (preimpresión)
- (2022) Infarto de miocardio, accidente cerebrovascular y embolia pulmonar después de la vacuna COVID-19 de ARNm BNT162b2 en personas de 75 años o más . Jam 327:80-82
- (2022) Infarto colónico gástrico y no mesentérico agudo después de la vacunación con ARNm COVID-19 . Asiático J. Surg. 45:1469-1470
- (2022) Arteritis renal aislada con infarto identificada después de la vacuna contra el SARS-CoV-2 . Circ. J.86 :1144
- (2022) Hemorragia intracraneal debido a la posible ruptura de una malformación arteriovenosa después de la vacunación con ARNm de BNT162b2 COVID-19 en una mujer joven coreana: informe de caso . Vacunas 10 (preimpresión)
- (2022) Hemorragia intracerebral por vasculitis después de la vacunación COVID-19: reporte de un caso . Acta Neurochir. Viena 164: 543-547
- (2022) Ruptura de aneurisma disecante de la arteria vertebral después de la vacunación anti-COVID-19 de ARNm: un informe de dos casos . NMC Caso Rep. J. 9:95-100
- (2022) Informe de un caso: encefalitis necrosante multifocal y miocarditis después de la vacunación con ARNm BNT162b2 contra Covid-19 . Vacunas 10:2022060308
- (2021) Innovador: la vacunación con BNT162b2 (Pfizer-BioNTech) induce la vacunación con BNT162b2 (Pfizer-BioNTech) antes del desarrollo de anticuerpos: un mecanismo novedoso para la activación inmunitaria mediante vacunas de ARNm . J. Immunol. 207:2405-2410
- (2022) Caracterización clínica y molecular de un caso raro de miositis asociada a la vacuna COVID-19 mRNA BNT162b2 . Vacunas 10 (preimpresión)
- (2022) Impresión inmunológica, amplitud del reconocimiento de variantes y respuesta del centro germinal en la infección y vacunación humana por SARS-CoV-2 . Celda (preimpresión)
- (2022) La infección persistente por el virus de la varicela zoster después de la vacunación con ARNm de COVID-19 se asoció con la presencia de proteína de pico codificada en la lesión . J. Cután. inmunol. Alergia (preimpresión)
- (2022) Encefalomielitis MOG después de la vacunación contra el síndrome respiratorio agudo severo coronavirus tipo 2 (SARS-CoV-2): informe de caso y revisión exhaustiva de la literatura . J. Neurol. (preimpresión)
- (2022) Encefalitis anti-LGI1 después de la vacunación COVID-19: una serie de casos . J. Neurol. (preimpresión)
- (2022) Múltiples síndromes autoinmunes que incluyen encefalomielitis diseminada aguda, miastenia grave y tiroiditis después de la vacunación COVID-19 basada en ácido ribonucleico mensajero: informe de un caso . Frente. Neurol. 13:913515
- (2021) Encefalomielitis diseminada aguda después de la vacunación contra el SARS-CoV-2 . clin. Neurol. neurocirugía 208:106839
- (2022) Estado epiléptico refractario de nueva aparición debido a encefalitis autoinmune después de la vacunación contra el SARS-CoV-2: reporte del primer caso . Frente. Neurol. 13:946644
- (2022) Encefalitis aguda después de la vacunación COVID-19: informe de un caso y revisión de la literatura . Tararear. vacuna Inmunotro. pag. 2082206
Este artículo fue publicado originalmente en https://doctors4covidethics.org/. Lea el original.
