Michael Palmer, MD y Sucharit Bhakdi, MD
Resumen: Este artículo analiza el estudio reciente de Bansal et al. [1] sobre la detección de proteína espiga en personas vacunadas con la vacuna de ARNm de Pfizer. El hallazgo más significativo es que la proteína espiga se encuentra en los exosomas, es decir, vesículas derivadas de células, durante al menos cuatro meses después de la segunda inyección. Esta persistencia sorprendentemente larga plantea la posibilidad de una inflamación sostenida dentro y daño a los órganos que expresan la proteína de pico.
1. La imagen hasta ahora: la expresión de la proteína Spike ocurre temprano y es de corta duración
Ogata et al. informaron sobre un estudio anterior sobre la expresión de la proteína espiga después de la vacunación con ARNm. [2]. Los pacientes de ese estudio habían recibido la vacuna Moderna, que es similar a la producida por Pfizer. En particular, ambas vacunas utilizan ARNm que incorpora pseudouridina en lugar de uridina, lo que afecta la estabilidad in vivo de las moléculas de ARN. Además, aunque las dos vacunas muestran alguna desviación de secuencia a nivel de ARN, codifican la misma secuencia de proteína de punta. Sin embargo, observamos que las nanopartículas de lípidos utilizadas con las dos vacunas difieren en su composición, lo que podría influir en la distribución de las vacunas en el cuerpo y el curso temporal de la expresión de la proteína pico.
1.1. Niveles plasmáticos del fragmento S1 de la proteína espiga y de la proteína espiga completa después de la vacunación con ARNm
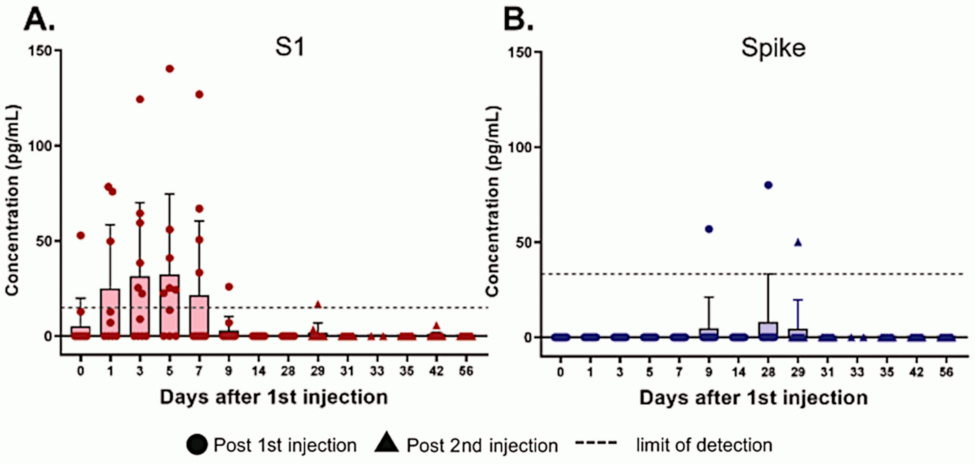
S1 es un fragmento de la proteína espiga que es escindida por las proteasas que ya están dentro de las células que expresan la proteína completa y que puede liberarse en el torrente sanguíneo una vez que la molécula de proteína escindida aparece en la superficie celular. El fragmento S1 puede unirse a los receptores ACE2 en trombocitos y otras células; esto puede contribuir a la patogenia de la COVID-19 [3] y también a los efectos adversos de la vacunación.
Según [2], los niveles de plasma sanguíneo del fragmento S1 aumentan rápidamente y vuelven a disminuir en no más de dos semanas. El aumento tardío de toda la proteína espiga es notable, aunque la expresión sigue siendo de una duración mucho más corta que la aparente en el estudio de Bansal (ver más abajo). Este hallazgo, sin embargo, puede deberse a la interferencia de los propios anticuerpos del paciente con esta medición (consulte la siguiente diapositiva). Por el contrario, el método analítico utilizado por Bansal et al. [1] elimina esta interferencia: detectará la proteína de pico incluso si ya está unida a los anticuerpos.
Tenga en cuenta que Ogata et al. no determinaron si la S1 o la proteína de pico de longitud completa que encontraron en el plasma estaba presente en forma libre o unida a partículas de exosomas (ver más adelante). Posiblemente, el S1 estaba libre, mientras que la proteína de pico de longitud completa podría haberse unido a los exosomas.
1.2. Niveles plasmáticos de S1 y anticuerpos de punta de longitud completa
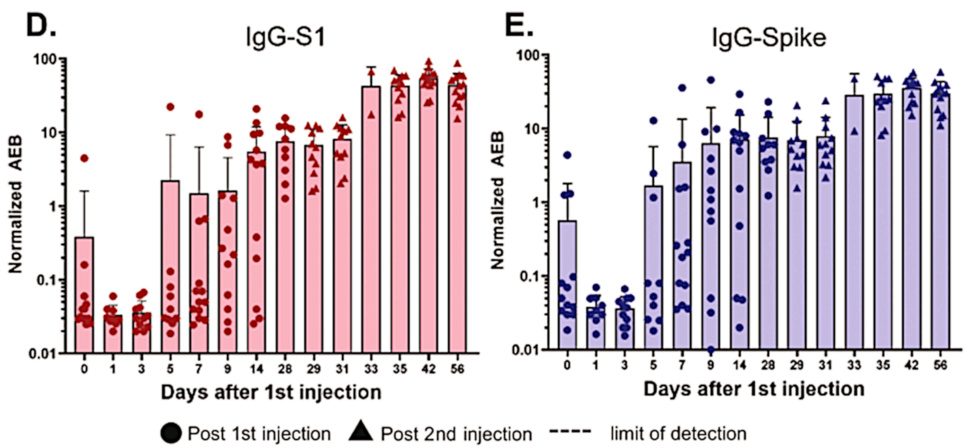
Estos datos también son del estudio de Ogata. Los anticuerpos tanto contra el fragmento S1 como contra la proteína de pico de longitud completa se desarrollan con un retraso de 1 a 2 semanas después de la primera inyección; después de la segunda dosis, vuelven a subir y más rápidamente. La ligera caída del día 0 al día 1 puede deberse a la rápida expresión de la proteína espiga, que se uniría a los anticuerpos preexistentes y los sacaría de la circulación.
La respuesta inmunitaria bastante rápida después de la primera inyección sugiere que se debe principalmente a la memoria inmunológica, que se debe a la inmunidad cruzada. Esto concuerda con un estudio de Nielsen et al. [4], quienes encontraron una respuesta igualmente rápida a la infección por SARS-CoV-2. Como ha señalado el Dr. Bhakdi, esta inmunidad cruzada generalizada significa que la mayoría de las personas están protegidas contra enfermedades graves debido al SARS-CoV-2 incluso sin vacunación [5].
Si comparamos esta figura con la anterior, vemos que los niveles del fragmento S1 circulante detectable y la proteína de pico de longitud completa caen de forma concomitante con el aumento de anticuerpos. Eso es de esperar, a la luz del método de detección utilizado por Ogata et al. [2] (ver las siguientes diapositivas).
1.3. Ensayo de Ogata: detección de proteínas de espiga utilizando anticuerpos acoplados a perlas magnéticas
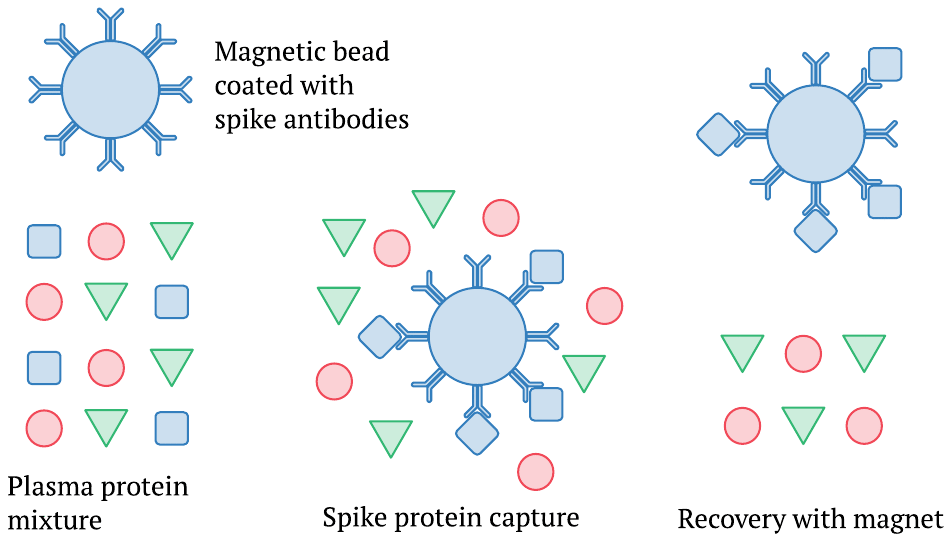
Esta imagen ilustra solo los pasos iniciales del procedimiento, es decir, la captura y separación de la proteína de pico de la mezcla compleja de proteínas que se encuentran en el plasma sanguíneo. El método emplea pequeñas perlas magnéticas que están recubiertas con anticuerpos contra la proteína espiga. Estos se mezclan con una muestra de plasma sanguíneo y se deja pasar un tiempo para que la proteína de pico o el fragmento S1 se una a las perlas. Posteriormente, las perlas se pueden recuperar mediante un imán. A esta separación le siguen otros pasos que nuevamente usan anticuerpos y finalmente generan una señal óptica; sin embargo, estos detalles no tienen por qué preocuparnos aquí.
1.4. Los anticuerpos inducidos por vacunas interfieren con la captura y detección de proteínas de punta
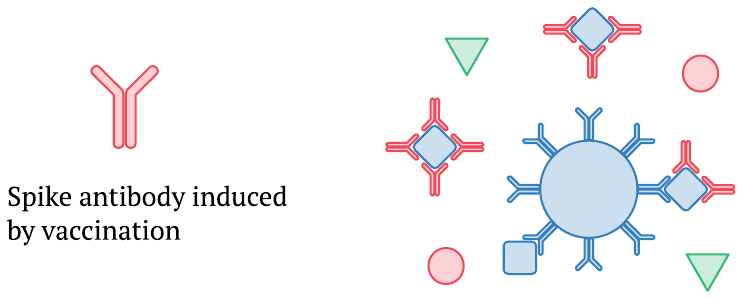
Una vez que se establece la reacción inmunitaria a la vacuna y aparecen anticuerpos de proteína de punta recién formados en el torrente sanguíneo, pueden unirse a las moléculas de proteína de punta S1 circulantes o de longitud completa y evitar su captura por los anticuerpos acoplados a las perlas magnéticas. Este efecto puede explicar por qué, en el estudio de Ogata, los niveles de S1 y la proteína de pico de longitud completa detectada en el plasma disminuyen a medida que aumenta la cantidad de anticuerpos. Además, los niveles más altos de pico de longitud completa llegan solo después de que ya está presente una cantidad sustancial de anticuerpos; es probable que esto también haga que se subestimen esos niveles más altos.
2. Sobre exosomas
Desde el estudio de Bansal et al. [1] se ocupa de la proteína de pico en los exosomas, primero hablaremos un poco sobre los exosomas como tales.
2.1. Los exosomas se forman pellizcando trozos de membrana celular y citoplasma.
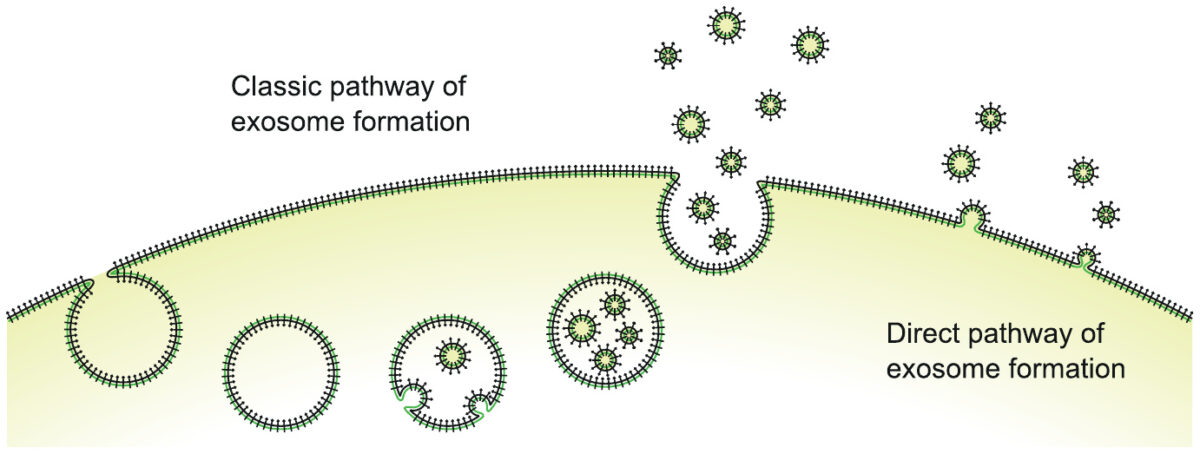
Los exosomas son pequeñas vesículas de membrana, formadas al arrancar fragmentos de membrana celular de la superficie celular y llenas de líquido intracelular y macromoléculas. Las dos vías distintas que se ilustran aquí, la formación intracelular con la subsiguiente liberación a granel, o la formación y liberación directamente en la superficie celular, son interesantes, pero no es necesario que nos preocupemos aquí.
Los exosomas transportan moléculas de proteína de la superficie celular (los pequeños «clubes» negros en la ilustración) y también macromoléculas intracelulares (proteínas y ARN). Pueden fusionarse con otras células o ser absorbidos por ellas y, por lo tanto, transmitir carga e información entre células.
2.2. Funciones fisiológicas sujetas a regulación por exosomas
- coagulación de la sangre
- Activación o supresión de respuestas inmunitarias
- Inflamación
- Crecimiento tumoral
Esta lista no es exhaustiva. Una revisión muy buena sobre el tema es [6], de la cual se adaptó la ilustración de la Sección 2.1.
2.3. Partículas virales y ‘exosomas’ en la infección por hepatitis B
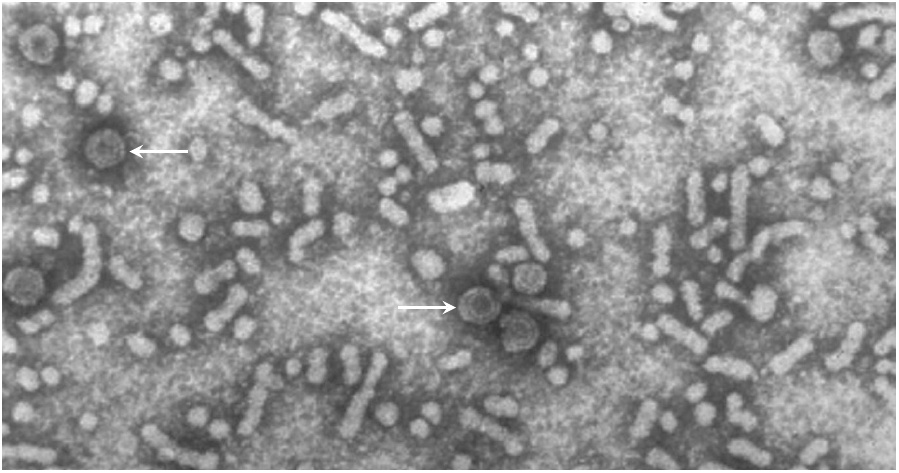
La hepatitis B es una enfermedad viral que se transmite por productos sanguíneos infectados o por contacto íntimo. En muchos pacientes, el virus da lugar a una infección crónica que el sistema inmunitario no consigue erradicar. En la sangre de tales pacientes, uno puede encontrar no solo partículas de virus infecciosos, sino también no infecciosos. Estos consisten en membranas de células huésped, decoradas con el antígeno de superficie viral, pero carecen de los ácidos nucleicos virales y las proteínas de la cápside en el interior.
En esta imagen, algunas partículas infecciosas están resaltadas con flechas; tienen forma regular y son más densas (más oscuras), así como de mayor diámetro que la mayoría de las otras partículas, que no son infecciosas. Estos últimos pueden considerarse exosomas, aunque normalmente no se los denomina como tales. Se ha propuesto que tales partículas vacías sirvan como señuelos para desviar la atención del sistema inmunitario de las partículas infecciosas reales y/o de las células infectadas.
También se observan exosomas o partículas no infecciosas similares con varios otros virus [6], y dados los datos informados por Bansal et al. [1] parece que podemos agregar el SARS-CoV-2 a la lista.
2.4. Exosomas ‘adecuados’ frente a vesículas apoptóticas
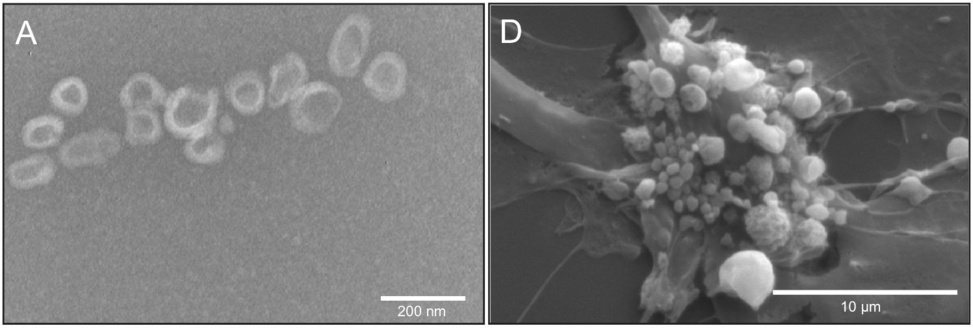
Otra distinción que debemos considerar es la que existe entre los exosomas regulares, que son liberados por células sanas o que al menos no están a punto de morir, y las vesículas liberadas por células que están experimentando apoptosis (muerte celular programada). La ilustración de la izquierda muestra exosomas regulares, mientras que la de la derecha muestra «ampolla en la membrana» en una célula del cordón umbilical apoptótica.
La apoptosis es importante en muchos contextos fisiológicos, incluido el desarrollo embrionario, la eliminación de células inmunitarias autorreactivas y también en la respuesta inmunitaria a las infecciones virales: los linfocitos T citotóxicos reconocen las células que expresan proteínas virales y las conducen a la apoptosis bombardeándolas con varios agentes citotóxicos. . Por lo tanto, después de la infección o la vacunación, es posible que la proteína del pico del SARS-CoV-2 se produzca tanto en los exosomas adecuados como en las vesículas apoptóticas.
Las vesículas apoptóticas suelen ser algo más grandes que los exosomas normales que son producidos por células vivas. Sin embargo, si observamos las barras de escala en estas dos imágenes, vemos que algunas de las vesículas apoptóticas incipientes no tienen más de unos pocos cientos de nanómetros de ancho; esto se superpone con la distribución de tamaño de los exosomas adecuados. Figura adaptada de [6].
3. Proteína Spike en exosomas después de la vacunación
Pasamos ahora a la evidencia presentada por Bansal et al. [1].
3.1. Detección de proteína de pico de SARS-CoV-2 en un exosoma con inmunogold
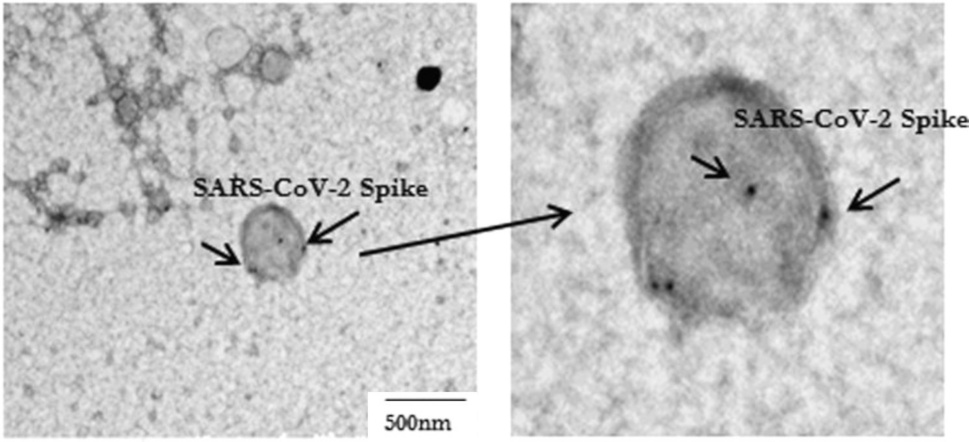
Esta imagen, adaptada de la Figura 1 en [1], muestra un exosoma o vesícula que lleva una proteína espiga, como es evidente por la unión de «inmunooro», es decir, pequeñas partículas de oro recubiertas de anticuerpos. La razón para emplear oro para detectar moléculas objetivo específicas en microscopía electrónica es la densidad muy alta de este elemento; las pesadas partículas de oro detienen el haz de electrones, provocando puntos negros como los que se muestran en esta imagen.
Tenga en cuenta que el exosoma en esta imagen es la única partícula mostrada por Bansal et al. y, además, es bastante grande. La comparación con la diapositiva anterior sugiere un posible origen apoptótico, aunque no podemos estar seguros de ello.
También notamos que la decoración con inmunooro es bastante escasa, lo que sugiere la presencia de solo una pequeña cantidad de moléculas de proteína de pico en esta vesícula. Sin embargo, al igual que con el ensayo de perlas magnéticas ilustrado en la Sección 1.4, esto puede deberse a la interferencia de los propios anticuerpos del paciente.
3.2. Evolución temporal de la proteína espiga en los exosomas y de los anticuerpos contra ella
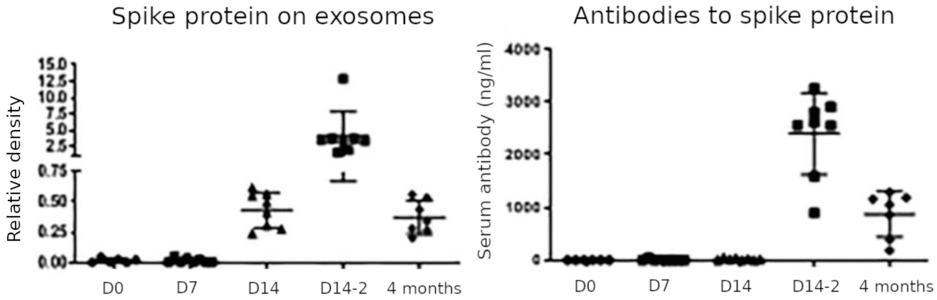
Esta figura resume los principales hallazgos del estudio. La proteína de pico en los exosomas fue insignificante el día de la primera inyección (D0) y permaneció así el día 7; aumentó el día 14 después de la primera inyección, alcanzó su punto máximo el día 14 después de la segunda inyección (D14-2) y volvió a disminuir pero permaneció detectable 4 meses después de la segunda inyección (que es 5 meses después de la primera). Los anticuerpos contra la proteína Spike siguieron un curso de tiempo similar, pero aún no se detectaron el día 14 después de la primera inyección. Basándose en el aparente retraso de la respuesta de los anticuerpos en relación con la aparición de la proteína espiga asociada al exosoma, los autores proponen que esta última es crucial para desencadenar la respuesta de los anticuerpos. Podemos hacer las siguientes observaciones:
- El hallazgo más notable y médicamente significativo es la expresión muy prolongada de la proteína espiga. Siempre que la proteína espiga pueda detectarse en vesículas de membrana derivadas de células, el sistema inmunitario atacará las células que liberan estas vesículas. Esto se aplica independientemente de si las vesículas son exosomas ‘auténticos’ o vesículas apoptóticas, aunque una explicación sencilla del aumento sorprendentemente tardío en la cantidad de proteína espiga en las vesículas, y en particular también de la mayor cantidad observada después de la segunda inyección, sería que estas vesículas surgen a través de la apoptosis de células que están siendo atacadas y destruidas por la respuesta inmune.
- La respuesta de anticuerpos muy lenta está en desacuerdo con la mayoría de los otros estudios, como por ejemplo el de Ogata et al. [2]. El ensayo empleado por Bansal et al. puede haber carecido de sensibilidad. Sin embargo, también debemos tener en cuenta que los dos estudios se relacionan con vacunas similares pero no idénticas (consulte la Sección 1).
- Bansal et al. buscó solo la proteína de pico en los exosomas, que se purificaron a partir de muestras de plasma mediante centrifugación y filtración; a diferencia de Ogata et al., no midieron la proteína de punta no unida a los exosomas en muestras de plasma completo. Esto podría explicar por qué Bansal et al. no detectó el pico temprano del fragmento de pico S1 que fue observado por Ogata et al.
3.3. El método de detección de proteína espiga de Bansal elimina la interferencia de los anticuerpos
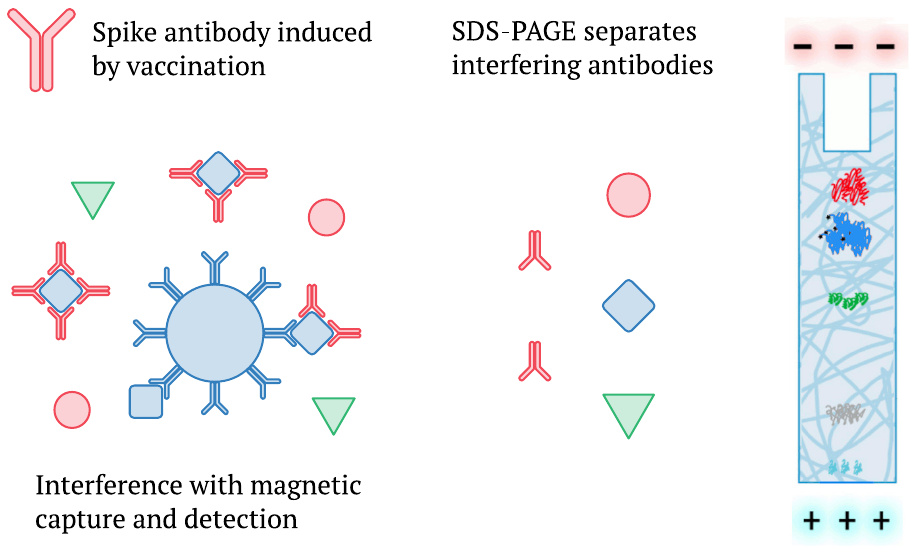
Mencionamos anteriormente que Ogata et al. [2] también había detectado una aparición tardía de la proteína de punta completa en el plasma (Sección 1.1), pero que sus mediciones probablemente estaban sujetas a interferencias por la creciente respuesta de anticuerpos (Sección 1.3). Es pertinente señalar que Bansal et al. [1] utilizaron electroforesis en gel de poliacrilamida SDS (SDS-PAGE) en lugar de perlas magnéticas para analizar las proteínas en sus muestras. SDS-PAGE, que separa las especies de proteínas de acuerdo con el peso molecular, romperá cualquier complejo que la proteína enriquecida pueda haber formado con los anticuerpos presentes en el plasma sanguíneo. Por lo tanto, medirá no solo la fracción no unida, sino también el total de la proteína presente. Al menos en este sentido, deberíamos preferir los datos informados por Bansal et al. a estudios anteriores.
3.4. Los ratones pueden ser inmunizados con exosomas aislados de humanos vacunados
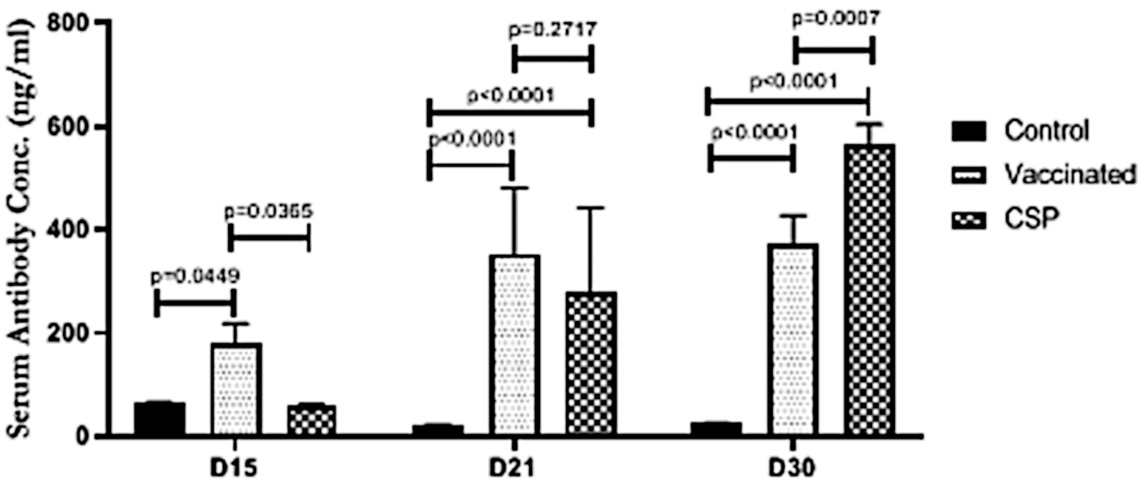
Hemos señalado anteriormente que Bansal et al. dedujo de sus observaciones del transcurso del tiempo que el pico unido al exosoma es necesario para inducir una respuesta de anticuerpos. Los experimentos representados en esta figura se llevaron a cabo para respaldar esa afirmación: a los ratones se les inyectaron exosomas aislados de personas vacunadas y se demostró que desarrollaban anticuerpos contra la proteína espiga.
Si bien el título de la figura en el estudio original no está del todo claro, parece que a los ratones ‘Vacunados’ se les administró proteína espiga purificada convencionalmente, mientras que a los ratones ‘CSP’ se les inyectaron los exosomas. Las concentraciones de anticuerpos se midieron los días 15, 21 y 30 después de la inyección.
En experimentos posteriores, también se demostró que los ratones expresaban cantidades aumentadas de las citoquinas interferón-γ y del factor de necrosis tumoral-α. Desde nuestro punto de vista, estos hallazgos no constituyen una evidencia muy sólida que respalde la hipótesis de los autores.
4. Conclusiones
- Persistencia duradera de la proteína espiga
- Inicio tardío de la expresión de la proteína pico, pero la observación se limita al pico en los exosomas
- El informe de EMA sobre Pfizer también informó un inicio relativamente lento de la expresión de picos; por otro lado, la aparición temprana de coágulos de sangre, etc. sugiere la aparición temprana de la expresión de picos
Mientras que algunas afirmaciones específicas hechas por Bansal et al. puede ser debatido, la persistencia muy duradera de la proteína de pico en el cuerpo se demuestra de manera convincente. Queda por determinar si es el ARNm que codifica la proteína espiga lo que persiste o, más bien, la proteína espiga misma. No obstante, siempre que la proteína espiga aparezca en exosomas o vesículas apoptóticas, debe estar presente en las membranas celulares; y mientras se encuentre allí, el sistema inmunitario atacará a esas células.
Se han informado casos de inflamación prolongada y deterioro de la función de los órganos tanto con la infección por el virus [7] como después de la vacunación [8]. Si bien la inflamación puede surgir de la autoinmunidad aguas abajo del daño tisular agudo intenso, la persistencia a largo plazo de la proteína pico después de la vacunación ofrece otra explicación sencilla y respalda la noción de que las vacunas darán lugar a una enfermedad inflamatoria persistente y de progresión lenta.
También debemos tener en cuenta que la proteína del pico persiste durante al menos el doble de tiempo que los participantes de los falsos y fraudulentos [9,10] ‘ensayos clínicos’ de Pfizer que se observaron, en promedio, después de la segunda vacunación [11]. De ello se deduce que los informes sobre los efectos secundarios que ocurrieron en esos ensayos no pueden estar completos.
Referencias
- Bansal, S. et al. (2021) Innovador: la vacunación con BNT162b2 (Pfizer-BioNTech) induce la vacunación con BNT162b2 (Pfizer-BioNTech) antes del desarrollo de anticuerpos: un mecanismo novedoso para la activación inmunitaria mediante vacunas de ARNm. J. Immunol. 207:2405-2410
- Ogata, AF et al. (2021) Antígeno circulante de la vacuna SARS-CoV-2 detectado en el plasma de receptores de la vacuna mRNA-1273. clin. Infectar. Dis. (preimpresión)
- Letarov, AV et al. (2021) Las partículas de proteína S1 de pico de SARS-CoV-2 libres pueden desempeñar un papel en la patogénesis de la infección por COVID-19. Bioquímica Mosc 86:257-261
- Nielsen, SS et al. (2021) SARS-CoV-2 provoca respuestas inmunes adaptativas robustas independientemente de la gravedad de la enfermedad. EBioMedicina 68:103410
- Bhakdi, S. et al. (2021) Carta a los médicos: cuatro nuevos descubrimientos científicos sobre la inmunidad y las vacunas contra la COVID-19: implicaciones para la seguridad y la eficacia .
- van der Pol, E. et al. (2012) Clasificación, funciones y relevancia clínica de las vesículas extracelulares. Farmacol. Apocalipsis 64:676-705
- Yong, SJ (2021) Síndrome Long COVID o post-COVID-19: fisiopatología putativa, factores de riesgo y tratamientos. Enfermedades infecciosas 53:737-754
- Anónimo, (2021) Datos de la vacuna OpenVAERS COVID .
- Thacker, PD (2021) Covid-19: Investigador denuncia problemas de integridad de datos en el ensayo de vacuna de Pfizer. BMJ pág. n2635
- Palmer, M. et al. (2021) Evidencia de expertos con respecto a la vacuna de ARNm COVID-19 de Comirnaty (Pfizer) para niños .
- Anónimo, (2020) Documento informativo de la FDA: Pfizer-BioNTech COVID-19 Vaccine .
Este artículo fue publicado originalmente en https://doctors4covidethics.org/. Lea el original.
