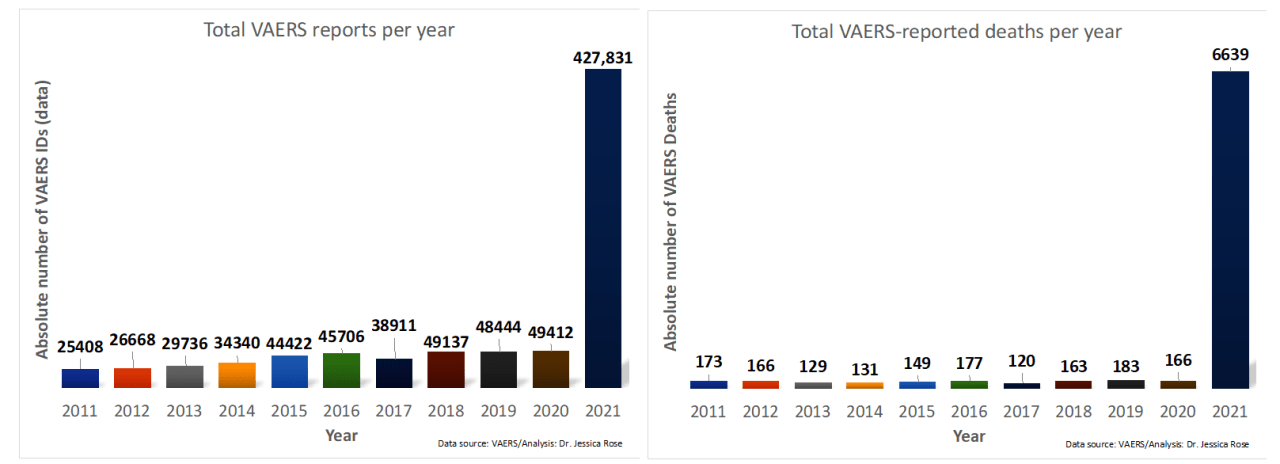
Gráficos de barras que muestran el número de informes de VAERS (izquierda) y muertes notificadas (derecha) por año durante la última década. (2021 es un conjunto de datos parcial).
Los patrones de eventos adversos, o un número inusualmente alto de eventos adversos reportados después de una vacuna en particular, se denominan ‘señales’. Si se identifica una señal mediante VAERS, los científicos pueden realizar estudios adicionales para determinar si representa un riesgo real.
Abstracto
Tras el inicio del despliegue y la administración global de las vacunas contra la COVID-19 el 17 de diciembre de 2020, en Estados Unidos, cientos de miles de personas han notificado eventos adversos (EA) mediante el Sistema de Notificación de Eventos Adversos a las Vacunas (VAERS). Hasta la fecha, aproximadamente el 50 % de la población estadounidense ha recibido dos dosis de los productos contra la COVID-19, con 427 831 EA notificados al VAERS hasta el 6 de agosto de 2021.
La farmacovigilancia (FV) es el proceso de recopilación, monitorización y evaluación de EA para detectar señales de seguridad con el fin de reducir los daños a la población en el contexto de agentes farmacéuticos y biológicos. Muchos de los problemas del VAERS se están volviendo cada vez más conocidos, especialmente en lo que respecta a la notificación y el registro de datos, debido a su amplio uso este año, lo que pone en entredicho su funcionalidad como sistema de farmacovigilancia.
Esta evaluación evalúa tres aspectos que responden a la pregunta sobre la farmacovigilancia de VAERS mediante el análisis de los datos de VAERS: 1. informes eliminados, 2. retraso en la entrada de informes y 3. recodificación de términos del Diccionario Médico para Actividades Regulatorias (MedDRA) de graves a leves. Se encontró que el conjunto de datos de VAERS disponible públicamente y actualizado más recientemente tenía N=1516 (0,4%) identificadores de VAERS eliminados («faltantes»). De estos datos faltantes, el 13% correspondía a fallecimientos, el 11% a COVID-19 y el 63% a eventos adversos graves (EAG). De estos datos faltantes de fallecimientos, solo el 59% correspondía a redundancias (nuevos identificadores de VAERS reasignados); el resto no se contabilizó.
Se detectó un retraso entre la aparición de EA y su registro en la base de datos pública del VAERS, que parece depender del tipo de EA. Por ejemplo, en el caso de los casos de COVID-19 posvacunación, aproximadamente a mediados de mayo, se añadieron retroactivamente 4100 informes (38 % del total) aproximadamente 8,5 semanas después de la fecha original de inicio. No se observó que los EA se degradaran a EA leves (EAM) en una cohorte analizada en 10 actualizaciones seleccionadas.
VAERS está diseñado para revelar posibles señales de riesgo de alerta temprana a partir de los datos, pero si estas señales no son detectables al recibirse, no son útiles como advertencias. Considerando la relevancia de las preocupaciones de seguridad ante el gran número de EA que se reportan al sistema VAERS en el contexto de los productos para la COVID-19, es esencial que el sistema VAERS se mantenga cuidadosa y meticulosamente. A pesar de la aparición de los Procedimientos Operativos Estándar (POE) para la COVID-19, VAERS carece de transparencia y eficiencia como sistema fotovoltaico, y requiere modificaciones o reemplazo.
Fuente
Critical Appraisal of VAERS Pharmacovigilance: Is the U.S. Vaccine Adverse Events Reporting System (VAERS) a Functioning Pharmacovigilance System? – Science, Public Health Policy and the Law
