
Este artículo fue publicado originariamente por https://doctors4covidethics.org/. Lea el original.
Michael Palmer, MD y Sucharit Bhakdi, MD
Este documento fue escrito para responder tres preguntas que nos planteó un abogado que cuestiona las aprobaciones y mandatos de la vacuna COVID-19 en su país de origen. Las respuestas también pueden ser de interés para los lectores de este sitio web.
1. ¿Qué evidencia hay actualmente disponible para demostrar que las partículas de la vacuna de ARNm cruzan la barrera hematoencefálica?
Esta cuestión no ha sido estudiada rigurosamente en humanos o animales. A continuación se presenta una descripción general de la evidencia limitada disponible.
1.1. Experimentación en animales con vacunas modelo
Tanto Pfizer [ 1 ] como Moderna [ 2 ] han realizado estudios en animales con vacunas modelo que contenían los mismos lípidos que las respectivas vacunas COVID-19, pero diferentes ARNm. En ambos casos, también se encontraron componentes de estas vacunas modelo en el tejido cerebral; Pfizer detectó el componente lipídico y Moderna detectó el ARNm. En ambos casos, las concentraciones en el tejido cerebral fueron significativamente más bajas que las de la sangre. Sin embargo, como quedará claro más adelante, estos hallazgos no significan que estas vacunas no dañarán el cerebro.
1.2. Sobre el mecanismo de transporte a través de la barrera hematoencefálica.
In vivo, las nanopartículas lipídicas del tipo utilizado en las vacunas de Pfizer y Moderna adquirirán una “corona biomolecular”, es decir, una capa exterior formada por las proteínas del propio cuerpo. Con este recubrimiento, se comportan de manera similar a las partículas de transporte de grasa naturales del cuerpo, las lipoproteínas . La captación celular de las nanopartículas lipídicas y su transporte a través de la barrera hematoencefálica están mediados, en particular, por un recubrimiento con las proteínas ApoB y ApoE [ 3 , 4 ] , que también cumplen la misma función con las lipoproteínas del propio cuerpo.
1.3. ¿Puede la proteína de pico afectar el transporte a través de la barrera hematoencefálica?
Si bien las nanopartículas lipídicas son importantes, no se debe pasar por alto el posible papel del ARNm contenido en la vacuna. Se sabe que la proteína de pico del SARS-CoV-2 puede alterar la función de la barrera hematoencefálica [ 5 – 8 ] . Es muy posible que las partículas de la vacuna sean absorbidas inicialmente por células fuera del cerebro, que luego producen y liberan proteína de pico en el torrente sanguíneo. Esta proteína de pico circulante podría actuar sobre la barrera hematoencefálica y facilitar el paso de más partículas de la vacuna al tejido cerebral. Por lo tanto, habría sido muy importante realizar estos estudios en animales con vacunas reales contra la COVID-19 en lugar de solo con vacunas modelo. Esto no habría sido particularmente difícil desde un punto de vista técnico. Con toda probabilidad, los fabricantes realizaron estos estudios pero optaron por mantener los resultados en el gabinete de venenos, o se saltaron deliberadamente estos experimentos para evitar el riesgo de obtener resultados desfavorables para ellos.
1.4. Barrera hematoencefálica e inyecciones de refuerzo.
La barrera hematoencefálica consta de dos capas de células: los endotelios de los pequeños vasos sanguíneos forman la capa interna y las células gliales del tejido cerebral circundante forman la capa externa. Es bien sabido que la barrera hematoencefálica se vuelve permeable durante la inflamación. Hasta que se demuestre lo contrario, se debe suponer que esto también se aplica a la inflamación de los vasos sanguíneos (vasculitis) en el cerebro inducida por las vacunas de ARNm; Que estas vacunas efectivamente causan diversas formas de vasculitis está ahora ampliamente documentado en la literatura [ 9 – 14 ] .
En este contexto, parece probable que la primera inyección de una vacuna de ARNm pueda provocar una inflamación de los vasos cerebrales, lo que suavizaría la barrera hematoencefálica. Las partículas de la vacuna aplicadas con la segunda inyección podrían pasar entonces sin obstáculos al tejido cerebral. Por lo tanto, no es suficiente investigar el transporte de vacunas de ARNm a través de la barrera hematoencefálica sólo después de una única inyección, como hicieron Pfizer y Moderna en sus experimentos con animales; en cambio, el transporte debería haberse medido también después de repetidas inyecciones.
1.5. Inyección intravenosa accidental de las vacunas.
Las vacunas contra el COVID-19 se inyectan por vía intramuscular. Con esta forma de aplicación se pretende aplicar el fármaco o vacuna en cuestión en el espacio extracelular fuera del torrente sanguíneo, de modo que permanezca en los tejidos, al menos inicialmente; desde allí, puede llegar lentamente al torrente sanguíneo o no llegar en absoluto. Los estudios en animales de los fabricantes antes citados demostraron que, efectivamente, una gran proporción de las vacunas modelo inyectadas por vía intramuscular permanecían en el tejido muscular. Todas las evaluaciones de riesgos publicadas por las distintas agencias reguladoras nacionales e internacionales suponen que este siempre será así.
Sin embargo, todo médico debe saber que incluso con una técnica cuidadosa, es decir, con aspiración previa [ 15 – 17 ] , la inyección puede ocurrir accidentalmente en el torrente sanguíneo. En estudios con animales, se ha observado que la miocarditis causada por vacunas de ARNm es más grave después de la inyección intravenosa que después de la inyección intramuscular [ 18 ] . Se debe suponer que lo mismo ocurre con los humanos y con los daños a otros órganos, incluido el cerebro.
1.6. Conclusión
En resumen, los datos disponibles no son suficientes para una estimación cuantitativa fiable del transporte de las vacunas de ARNm a través de la barrera hematoencefálica, pero demuestran cualitativamente que las nanopartículas lipídicas entran en el cerebro. Las evaluaciones optimistas de las autoridades reguladoras sobre este tema ignoran riesgos graves e importantes factores de confusión y, por lo tanto, no son realistas.
2. ¿Cuánto tiempo pueden permanecer las nanopartículas de la vacuna en el cerebro?
En primer lugar, habría que aclarar que las nanopartículas como tales probablemente no duren mucho tiempo en ninguna parte del cuerpo: poco después de ser absorbidas por una célula, los lípidos se separarán del ARN. Sólo después de que el ARN se haya liberado de esta manera podrá iniciar la síntesis de la proteína de pico dentro de la célula. A partir de entonces, lo más probable es que el período de actividad biológica lo decida la estabilidad del ARN, aunque los componentes lipídicos también pueden contribuir a la toxicidad de la vacuna de ARNm.
Al igual que con la cuestión del transporte al cerebro, los fabricantes no han proporcionado datos suficientes y fiables sobre la persistencia de los ARNm de la vacuna en el tejido cerebral. El documento de la EMA sobre Moderna nuevamente solo contiene datos sobre la vacuna modelo, no sobre la vacuna COVID real. Según se informa, tres días después de la inyección, el ARNm de la vacuna modelo seguía siendo detectable sólo en el tejido muscular, los ganglios linfáticos y el bazo. Pfizer no informó mediciones directas de ARN, sino sólo datos sobre la actividad de la proteína codificada por la vacuna modelo (luciferasa). Esta actividad decayó con una vida media de aproximadamente un día [ 1 ] . Sin embargo, no se realizaron mediciones en el cerebro de los animales.
En ambos casos, sigue siendo incierto hasta qué punto estos hallazgos de experimentos con animales se aplican a la vida útil, dentro del cerebro humano, del ARNm que codifica la proteína de pico del SARS-CoV-2. Sin embargo, veremos en la siguiente sección que hay motivos para creer que la expresión de la proteína de pico en el cerebro humano, inducida por la vacunación, puede durar mucho más de lo que sugieren estos datos en animales.
3. ¿Qué daño pueden causar las nanopartículas de las vacunas al cerebro?
Debemos señalar desde el principio que, cuando se trata de daño cerebral, la barrera hematoencefálica es menos crucial de lo que podría suponerse; Las razones quedarán claras a continuación.
3.1. Ataque
Ahora está claro que los eventos adversos causados por las vacunas COVID genéticamente modificadas (tanto basadas en ARNm como en adenovirus) comienzan muy a menudo con daño a los vasos sanguíneos (ver Figura 1 ). La lesión vascular conduce entonces a la formación de coágulos de sangre; Los tejidos y órganos que dependen de estos vasos obstruidos para su suministro de sangre resultarán dañados o incluso perecerán. El accidente cerebrovascular y el ataque cardíaco son ejemplos sencillos y prácticamente importantes de este mecanismo patogénico [ 19 – 21 ] . Otra variación es la hemorragia tras la rotura de vasos sujetos a inflamación inducida por la vacuna [ 22 – 24 ] . Para estas lesiones es suficiente que las partículas de la vacuna sean absorbidas de la sangre circulante hacia las células de las paredes de los vasos sanguíneos. Estas células luego expresarán la proteína de pico, un antígeno extraño, y por lo tanto provocarán la ira del sistema inmunológico, que luego causará el daño real. Tenga en cuenta, sin embargo, que en este escenario las partículas no necesitan cruzar ninguna barrera anatómica importante; y, en particular, no necesitan cruzar la barrera hematoencefálica para dañar los vasos cerebrales y provocar un accidente cerebrovascular.
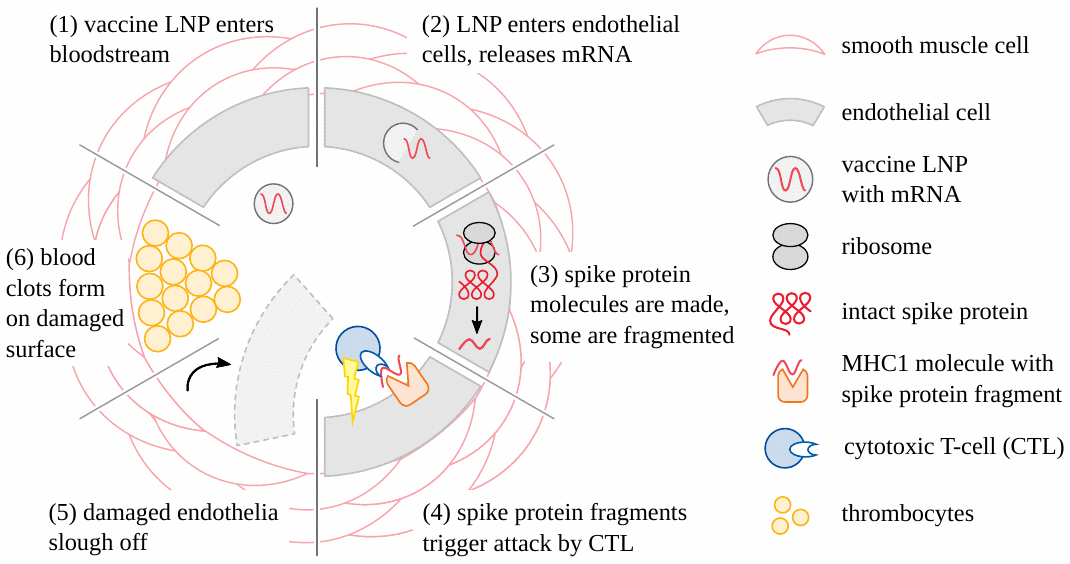
3.2. Inflamación del cerebro y la médula espinal.
Además de accidentes cerebrovasculares, las vacunas de ARNm también han provocado muchos casos de encefalitis y mielitis, es decir, inflamación del cerebro y de la médula espinal, respectivamente, y en ocasiones también de ambos a la vez (encefalomielitis). Los mecanismos patogénicos son los mismos en las tres enfermedades; En aras de la simplicidad, a continuación utilizaremos sólo el término «encefalitis».
3.2.1. Encefalitis debido a una reacción inmune contra la proteína de pico.
Se debe esperar que este mecanismo patogénico opere desde los primeros principios de la inmunología. ¿Cómo podría demostrarse en un caso determinado de encefalitis? Los siguientes criterios harían que dicho diagnóstico fuera al menos muy probable:
- aparición entre unos días y unas pocas semanas después de la inyección de la vacuna;
- detección de linfocitos y otras células inflamatorias dentro del tejido cerebral;
- detección de proteína de pico en los focos de inflamación.
Cabe señalar que los criterios 2 y 3 sólo pueden cumplirse mediante exámenes histopatológicos; En el caso del cerebro, normalmente sólo se realizan después de la autopsia, ya que las biopsias de este órgano son especialmente precarias.
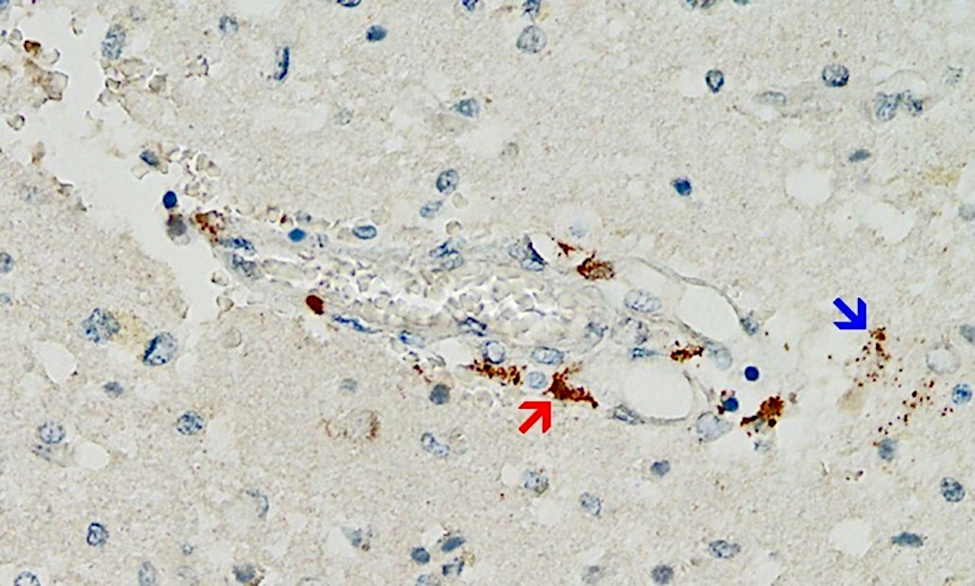
Aunque es probable que este mecanismo sea de gran importancia, hasta ahora la evidencia que lo respalda es escasa, simplemente porque los patólogos no lo han estado buscando. Sin embargo, se acaba de publicar un primer informe de caso que cumple todos los criterios anteriores [ 25 ] (ver Figura 2 ). Este estudio muy meticuloso también descartó que la expresión detectada de la proteína de pico fuera causada por la infección con el virus en sí y no por la vacunación.
El paciente en cuestión había recibido inicialmente una única inyección de la vacuna basada en adenovirus de AstraZeneca, seguida de dos inyecciones de la vacuna de ARNm de Pfizer. La última inyección se le había aplicado tres semanas antes del momento de la muerte. Se detectó una marcada expresión de la proteína de pico en los capilares cerebrales y también en las células de la glía del tejido cerebral, muy probablemente causada por la dosis más reciente de la vacuna de ARNm. Por lo tanto, se debe suponer que la proteína de pico sobrevive al menos varias semanas después de la aplicación de las vacunas de ARNm y, muy probablemente, también se sintetiza continuamente durante este tiempo. Este hallazgo se hace eco de estudios previos sobre diversos tejidos además del cerebro y la sangre [ 26 – 29 ] . La expresión de la proteína de pico en las células de la glía también muestra inequívocamente que una o ambas vacunas pueden cruzar la barrera hematoencefálica.
3.2.2. Encefalitis autoinmune
En este mecanismo patogénico, la conexión con la vacunación es indirecta: la vacuna primero desencadena una inflamación, que tal vez ni siquiera tenga que afectar directamente al cerebro; y en el contexto de esta inflamación se activa una respuesta inmune no sólo contra la proteína de pico sino también contra una o más proteínas del propio cuerpo u otras biomoléculas (autoantígenos). Luego, el sistema inmunológico puede atacar estos mismos autoantígenos dentro de órganos diana inicialmente no afectados, incluido el cerebro, y desencadenar inflamación allí también.
Los síntomas clínicos, y también los hallazgos de la autopsia cuando se utilizan métodos de rutina, probablemente serán muy similares a los de una reacción inmune al pico. Por lo tanto, ¿cómo se podría decidir si la encefalitis es provocada por la proteína de pico o por un autoantígeno? En una verdadera encefalitis autoinmune, se deberían esperar los siguientes hallazgos:
- los autoanticuerpos contra los autoantígenos en cuestión deben poder detectarse en muestras de sangre;
- la proteína de pico no debería ser detectable en las lesiones inflamatorias;
- la conexión temporal con la vacunación puede ser menos estrecha, porque los autoantígenos se producen en el cuerpo de forma perpetua.
Jarío et al. [ 30 ] informaron un caso de encefalitis con autoanticuerpos positivos en un paciente que había recibido inicialmente dos dosis de la vacuna basada en adenovirus de AstraZeneca, seguidas de una dosis de la vacuna de ARNm de Pfizer. En este paciente, una proteína expresada en el cerebro, la glicoproteína de oligodendrocitos de mielina (MOG), era el autoantígeno. Estos autores también proporcionaron una visión general de otros veinte casos previamente informados en la literatura. En tres de estos casos se había utilizado una vacuna de ARNm, mientras que los diecisiete casos restantes estaban asociados a la vacuna de AstraZeneca. Dado que ninguno de estos casos fue fatal, no se obtuvo evidencia histopatológica positiva o negativa de expresión de la proteína de pico.
Asioli et al. [ 31 ] informaron cuatro casos de encefalitis en los que se detectaron autoanticuerpos contra la proteína LGI1. Tres de estos casos, todos de la misma ciudad (Bolonia), se produjeron tras la inyección de vacunas de ARNm. Un caso particularmente sorprendente fue reportado por Poli et al. [ 32 ] . Este paciente desarrolló tres enfermedades autoinmunes diferentes simultáneamente: encefalitis desmielinizante, miastenia y tiroiditis. Sin embargo, no se detectaron autoanticuerpos específicos que pudieran explicar la encefalitis en este caso.
3.2.3. Encefalitis autoinmune con anticuerpos negativos
En varios informes de casos de encefalitis después de la inyección de vacunas de ARNm, se realizó el diagnóstico de «encefalitis autoinmune con anticuerpos negativos» ( [ 33 – 35 ] . Sin duda, es razonable suponer que en muchos de estos casos un autoantígeno no identificado puede haber sido la causa. por otro lado, sin histopatología, a menudo será imposible decidir si un caso determinado de encefalitis fue causado por una reacción inmune contra un autoantígeno desconocido o contra la proteína de pico.
3.3. Conclusión
Se han notificado numerosos casos de encefalitis, mielitis y encefalomielitis tras el uso de vacunas de ARNm y también de vacunas basadas en adenovirus. En casos específicos se ha demostrado que tanto las reacciones autoinmunes como una reacción inmune contra la proteína de pico son causantes. La proporción respectiva de cada forma entre el número total de casos clínicos de encefalitis no puede determinarse sobre la base de la evidencia actualmente disponible.
4. Resumen
Existen numerosos informes de casos de trastornos del sistema nervioso central tras el uso de vacunas de ARNm contra la COVID-19. Estos trastornos incluyen accidente cerebrovascular, hemorragia cerebral y encefalitis. No es necesario que las vacunas atraviesen la barrera hematoencefálica para dañar el cerebro; sin embargo, esto debe considerarse posible, especialmente después de inyecciones repetidas o inyección intravenosa accidental, y es probable que agrave el curso clínico de la encefalitis.
Referencias
- (2020) Vacuna de ARNm del SARS-CoV-2 (BNT162, PF-07302048) 2.6.4 Declaración resumida del estudio farmacocinético [traducción al inglés] .
- (2021) Informe de evaluación de la EMA: COVID-19 Vaccine Moderna .
- (2002) Transporte mediado por apolipoproteínas de fármacos unidos a nanopartículas a través de la barrera hematoencefálica . Revista de focalización de drogas 10:317-25
- (2020) La corona biomolecular de nanopartículas lipídicas para terapia génica . Bioconjugador. Química. 31:2046-2059
- (2020) La proteína de pico del SARS-CoV-2 altera la función de la barrera en modelos in vitro de microfluidos estáticos 2D y 3D de la barrera hematoencefálica humana . Neurobiol. Dis. 146:105131
- (2021) La proteína Spike del SARS-CoV-2 altera la integridad de la barrera hematoencefálica mediante la activación de RhoA . J. Neuroinmune Pharmacol. 16:722-728
- (2022) Penetración de la proteína espiga del SARS-CoV-2 a través de la barrera hematoencefálica, revelada por una combinación de un sistema modelo de cultivo de células humanas y biodetección óptica . Biomedicinas 10 (preimpresión)
- (2021) La proteína S1 del SARS-CoV-2 cruza la barrera hematoencefálica en ratones . Nat. Neurociencias. 24:368-378
- (2022) Vasculitis necrotizante de novo y recurrente después de la vacunación contra COVID-19 . Clínico. Riñón J. 15:560-563
- (2022) Vasculitis leucocitoclástica (vasculitis cutánea de pequeños vasos) después de la vacunación COVID-19 . J. Autoinmune. 127:102783
- (2022) Arteritis de células gigantes que se presenta con tos crónica y dolor de cabeza después de la vacuna COVID-19 con ARNm de BNT162b2 . QJM (preimpresión)
- (2022) Informe de un caso de vasculitis asociada a MPO-ANCA después de una vacunación de refuerzo heteróloga con mRNA1273 COVID-19 . J. Medicina coreana. Ciencia. 37:e204
- (2022) Vasculitis IgA de nueva aparición comprobada por biopsia renal después de recibir la vacuna mRNA-1273 COVID-19: informe de caso . Informe de caso del CEN (preimpresión)
- (2022) Vasculitis sistémica después de la vacunación con ARNm del SARS-CoV-2 demostrada en PET/CT con FDG . Clínico. Núcleo. Medicina. 47:e403-e405
- (2022) ¿Aspirar o no aspirar? Consideraciones para las vacunas COVID-19 . Farmacéutico. Representante (preimpresión)
- (1999) Técnicas de inyección segura . Enfermeras. Pararse. 13:47-53; prueba 54
- (1988) Lesiones intravasculares por penicilina intramuscular . Clínico. Pediatra. Fila 27:85-90
- (2021) La inyección intravenosa de la vacuna de ARNm de COVID-19 puede inducir miopericarditis aguda en un modelo de ratón . Clínico. Infectar. Dis. (preimpresión)
- (2022) Infarto de miocardio, accidente cerebrovascular y embolia pulmonar después de la vacuna COVID-19 de ARNm de BNT162b2 en personas de 75 años o más . JAMA 327:80-82
- (2022) Infarto agudo de colon gástrico y no mesentérico después de la vacunación con ARNm COVID-19 . Asiático J. Surg. 45:1469-1470
- (2022) Arteritis renal aislada con infarto identificada después de la vacuna contra el SARS-CoV-2 . Circo. J.86 :1144
- (2022) Hemorragia intracraneal debido a una posible ruptura de una malformación arteriovenosa después de la vacunación con ARNm de BNT162b2 COVID-19 en una joven coreana: informe de un caso . Vacunas 10 (preimpresión)
- (2022) Hemorragia intracerebral debida a vasculitis después de la vacunación contra COVID-19: reporte de un caso . Acta Neurochir. Viena 164:543-547
- (2022) Rotura de aneurisma disecante de la arteria vertebral después de la vacunación con ARNm anti-COVID-19: informe de dos casos . Representante del caso NMC J. 9:95-100
- (2022) Informe de un caso: encefalitis necrotizante multifocal y miocarditis después de la vacunación con ARNm de BNT162b2 contra Covid-19 . Vacunas 10:2022060308
- (2021) Vanguardia: los exosomas circulantes con proteína de pico COVID son inducidos por la vacunación BNT162b2 (Pfizer-BioNTech) antes del desarrollo de anticuerpos: un nuevo mecanismo para la activación inmunitaria mediante vacunas de ARNm . J. Inmunol. 207:2405-2410
- (2022) Caracterización clínica y molecular de un caso raro de miositis asociada a la vacuna COVID-19 del ARNm de BNT162b2 . Vacunas 10 (preimpresión)
- (2022) Impresión inmune, amplitud del reconocimiento de variantes y respuesta del centro germinal en la infección y vacunación humana por SARS-CoV-2 . Celda (preimpresión)
- (2022) La infección persistente por el virus varicela zóster después de la vacunación con ARNm COVID-19 se asoció con la presencia de proteína de pico codificada en la lesión . J. Cután. Inmunol. Alergia (preimpresión)
- (2022) Encefalomielitis MOG después de la vacunación contra el síndrome respiratorio agudo severo coronavirus tipo 2 (SARS-CoV-2): reporte de caso y revisión exhaustiva de la literatura . J. Neurol. (preimpresión)
- (2022) Encefalitis anti-LGI1 después de la vacunación COVID-19: una serie de casos . J. Neurol. (preimpresión)
- (2022) Síndromes autoinmunes múltiples que incluyen encefalomielitis aguda diseminada, miastenia gravis y tiroiditis después de la vacunación contra el COVID-19 a base de ácido ribonucleico mensajero: informe de un caso . Frente. Neurol. 13:913515
- (2021) Encefalomielitis aguda diseminada después de la vacunación contra el SARS-CoV-2 . Clínico. Neurol. Neurocirugía. 208:106839
- (2022) Estado epiléptico refractario de nueva aparición debido a encefalitis autoinmune después de la vacunación contra el SARS-CoV-2: informe del primer caso . Frente. Neurol. 13:946644
- (2022) Encefalitis aguda después de la vacunación contra COVID-19: reporte de un caso y revisión de la literatura . Tararear. Vacuna. Inmunotro. pag. 2082206
