-
anemptytextllineSubvenciones directas a los medios de comunicación privados de España por razones de pandemia PRIMERA INYECCIÓN DE DINERO 15.000.000 de Euros RAZÓN: Las empresas de servicios audiovisuales han visto aumentar su audiencia por las medidas de confinamiento, pero al mismo tiempo están...
-
anemptytextllineProtocolos hospitalarios COVID-19 Referencias oficiales sobre protocolos aplicados: Marzo 2020. Guía rápida del Protocolo COVID Hospital IFEMA Mayo del 2020. Protocolo de manejo clínico de los pacientes con COVID. Hospital Puerta del Hierro Majadahonada (Madrid) Mayo de 2020– Comissió Assessora per al Tractament...
-
anemptytextllineSARS-COV-2, un virus nunca aislado + PCR, una prueba no diagnóstica: Para desmontar este circo mediático/político/farmacéutico partimos de que este supuesto virus SARS-COV-2 sigue sin ser aislado tal y como indica el informe original Detection of 2019 novel coronavirus (2019-nCoV) by real-time RT-PCR remitido a Eurosurveillance en febrero de...
Referencias oficiales sobre protocolos aplicados:
- Marzo 2020. Guía rápida del Protocolo COVID Hospital IFEMA
- Mayo del 2020. Protocolo de manejo clínico de los pacientes con COVID. Hospital Puerta del Hierro Majadahonada (Madrid)
- Mayo de 2020– Comissió Assessora per al Tractament de la Infecció per SARS CoV 2- Generalitat Cataluña
- Junio del 2020. Documento técnico Manejo clínico del COVID-19: atención hospitalaria – Ministerio de Sanidad
- Abril del 2020. Protocolos de analgosedación en pacientes con infección por coronavirus en caso de desabastecimiento. recomendaciones del Grupo de trabajo de sedación, analgesia y delirium de la sociedad española de medicina intensiva, crítica y unidades coronarias (SEMICYUC).
- Octubre del 2020. La organización de la asistencia hospitalaria: Revisión de circuitos hospitalarios y con centros extrahospitalarios.Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica.
- 2020. Protocolo farmacológico del hospital “La Fe” de Valencia
- Enero del 2022- Protocolo de tratamiento de la COVID-19- Hospital Virgen del Rocio
- Actual. Tratamientos disponibles sujetos a condiciones especiales de acceso para el manejo de la infección respiratoria por SARS-CoV-2. Agencia Española de medicamentos. Ministerio de España.
- Marzo 2020.Tratamientos disponibles sujetos a condiciones especiales de acceso para el manejo de la infección respiratoria por SARS-CoV-2. Agencia Española de medicamentos. Ministerio de España.
Kaletra, Remdesivir, Tocilizumab, Fentanilo, Propofol, Morfina y entubado... Estos son algunos de los medicamentos incluidos en el combo de protocolos recomendado por la OMS para el tratamiento de las personas más vulnerables diagnosticadas con COVID. Como podemos observar simplemente leyendo las fichas técnicas de los productos y los efectos adversos frecuentes, la mayoría de estos medicamentos pueden producir la muerte y tienen reacciones adversas frecuentes cardíacas y potencialmente mortales, además de ser en su mayoría tratamientos experimentales en humanos y con resultados preocupantes en animales.
Lo más llamativo, es que estos tratamientos potencialmente mortales se han administrado de forma combinada y abusiva a los supuestos enfermos COVID, que han visto como sus síntomas empeoraban progresivamente a medida que el protocolo avanzaba y se intensificaba:
Lopinavir-Ritonavir (Kaletra) | Algunos datos indicados en la ficha técnica del producto: Se deben hacer tests de laboratorio antes del inicio de la terapia con lopinavir/ritonavir y se debe realizar una estrecha monitorización durante el tratamiento. | Durante la post-comercialización, se han comunicado casos potencialmente mortales de toxicidad cardiaca (incluyendo bloqueo auriculoventricular completo (AV), bradicardia y cardiomiopatía), acidosis láctica, insuficiencia renal aguda, depresión del SNC y complicaciones respiratorias. | No se pueden descartar potenciales efectos cardiacos de este medicamento en humanos.| + INFORMACIÓN
Remdesivir (Veklury) | Algunos datos indicados en la ficha técnica del producto: “se encuentra en fase de investigación porque todavía se está estudiando” y “se conoce información limitada sobre la seguridad y eficacia de usar Veklury para tratar a personas hospitalizadas por COVID-19”. | Los posibles efectos secundarios de Veklury son los siguientes frecuentes: Trastornos cardíacos, Lesiones traumáticas, intoxicaciones y complicaciones de procedimientos terapéuticos. | El documento oficial añade que “No mucha gente ha recibido Veklury. Pueden producirse efectos secundarios graves e inesperados.” | Toxicología: Tras la administración intravenosa (bolo lento) de remdesivir a monos Rhesus y ratas, se produjo toxicidad renal grave después de tratamientos de corta duración (…) y la muerte imprevista de un animal a un nivel de dosis de 20 mg/kg/día.| + INFORMACIÓN
Tocilizumab (RoActemra) | es un un costoso medicamento para la artritis reumatoide de la farmacéutica Roche del que aún no hay evidencia sobre su seguridad y eficacia y según el laboratorio indica, sus efectos secundarios frecuentes o muy frecuentes son “infección en vías respiratorias, neumonía, dolor abdominal, ulceración oral” entre otros.| Algunos datos indicados en la ficha técnica del producto: Se han notificado infecciones graves y en algunos casos mortales en pacientes que reciben agentes inmunosupresores incluido RoActemra | Se ha notificado reactivación viral (por ejemplo, virus de la hepatitis B) en pacientes con AR que estaban en tratamiento con terapias biológicas.| Se han notificado reacciones de hipersensibilidad graves asociadas a la perfusión de RoActemra. Estas reacciones pueden ser graves y potencialmente mortales. | Durante la comercialización se han notificado casos de enfermedad pulmonar intersticial (incluyendo neumonía, y fibrosis pulmonar) alguno de los cuales fue mortal.| + INFORMACIÓN
Baricitinib (Olumiant) | Otro fármaco anteriormente prescrito para la artritis reumatoide, según indica vademecum.es en sus advertencias, causa aumento en el riesgo de Infecciones, no se recomienda en pacientes con infecciones activas y aumenta el riesgo de reactivación viral, entre otros efectos adversos | + INFORMACIÓN
Fentanilo | Según indica su ficha técnica: El uso de fentanilo en pacientes que no hayan recibido opioides anteriormente se ha asociado a casos muy poco frecuentes de depresión respiratoria significativa o mortalidad cuando se usa como terapia de opioides inicial. Existe el riesgo de hipoventilación grave o mortal, aunque se utilice la menor dosis de fentanilo al iniciar la terapia en pacientes que no hayan recibido opioides anteriormente.| Fentanilo puede producir bradicardia | Existe la posibilidad de que se desarrolle el síndrome de la serotonina, que puede ser mortal, si se usan al mismo tiempo principios serotoninérgicos activos | + INFORMACIÓN
Propofol | Según su ficha técnica puede producir: Insuficiencia cardíaca, circulatoria o pulmonar e hipovolemia | Propofol no debe administrarse a pacientes con insuficiencia cardiaca avanzada. | El uso de perfusiones de emulsión de propofol para la sedación en cuidados intensivos se ha asociado con un conjunto de alteraciones metabólicas y fallos orgánicos sistémicos que pueden provocar la muerte.| + INFORMACIÓN
Morfina | Según la fecha técnica del producto, este medicamento está contraindicado en pacientes con depresión respiratoria o enfermedad respiratoria obstructiva grave.| El perfil toxicológico de la morfina es similar al del resto de analgésicos opiáceos, aunque los efectos aparecen con más frecuencia. Los efectos adversos más característicos son (>1/1000, <1/100): Trastornos cardíacos: parada cardiaca, taquicardia y bradicardia, hipertensión, hipotensión, hipertensión intracraneal, colapso. | +INFORMACIÓN
Entubado | Un estudio multicéntrico internacional liderado por Vincenzo Russotto, de la Escuela de Medicina y Cirugía de la Universidad de Milano-Bicocca (Italia), revela que el 45,2 por ciento de los pacientes sometidos a este procedimiento experimentaron al menos un evento clínico mayor, y uno de cada tres (32,8 por ciento) murió en la UCI: De entre los eventos clínicos, el principal fue la inestabilidad cardiovascular, presente en el 42,6 por ciento de los pacientes. El siguiente más común fue la hipoxemia severa (9,3 por ciento) y, después, el paro cardiaco (3,1 por ciento). | +INFORMACIÓN
*A estos protocolos que han acabado con la vida de cientos de miles de personas debemos sumar dos factores claves: La retirada total de la alimentación tras el ingreso en UCI, el aislamiento y la incomunicación, hechos agravantes y tortuosos para los pacientes.
Esperanza está convencida de que su hermana Alelí fue asesinada a través de protocolos. La historia de Alelí es una historia de tortura y terror con el peor de los finales posibles.
Caso completo y documentos asociados: https://periodistasporlaverdad.com/iatrogenia-como-acabar-con-la-vida-de-un-paciente-aleli-loo/
Una familia vió como los protocolos asesinos acababan con la vida de la madre, cuando el padre ingresó también en UCI, lucharon por sacarlo del hospital y lograron salvarle la vida en el último momento.
Mar, todavía conmocionada con la reciente muerte de su tía, nos cuenta como los protocolos hospitalarios acabaron con su vida en muy poco tiempo.
Miles de familias denuncian que los protocolos COVID acabaron con la vida de sus familiares, la mayoría de estos supuestos enfermos COVID entraron al hospital con síntomas leves, fueron empeorando progresivamente a medida que los protocolos avanzaban y finalmente fallecieron en el hospital: https://www.protocolkills.com/blog
Fichas médicas de los productos suministrados en residencias y hospitales a los enfermos diagnosticados con COVID-19
Remdesivir (Veklury)
Ver ficha técnica del producto
Remdesivir (Veklury ®), tal como indica su prospecto «se encuentra en fase de investigación porque todavía se está estudiando» y «se conoce información limitada sobre la seguridad y eficacia de usar Veklury para tratar a personas hospitalizadas por COVID-19». Los posibles efectos secundarios de Veklury son los siguientes: reacciones alérgicas, incluidas reacciones graves: presión arterial baja, cambios en el ritmo cardíaco, dificultad para respirar, sibilancias, hinchazón en los labios, la cara o la garganta, erupción cutánea, náuseas, vómitos, sudoración o temblores y aumentos en los niveles de enzimas hepáticas. El documento oficial añade que «No mucha gente ha recibido Veklury. Pueden producirse efectos secundarios graves e inesperados.»
4.4 Advertencias y precauciones especiales de empleo
Se han observado reacciones de hipersensibilidad que incluyen reacciones anafilácticas y relacionadas con la perfusión durante y después de la administración de remdesivir. Los signos y los síntomas pueden incluir hipotensión, hipertensión, taquicardia, bradicardia, hipoxia, pirexia, disnea, sibilancia, angioedema, erupción, náuseas, vómitos, diaforesis y escalofrío.
El tratamiento con remdesivir no se debe iniciar en pacientes con alanina aminotransferasa (ALT) ≥5 veces el límite superior de la normalidad al inicio.
• Se debe interrumpir el tratamiento con remdesivir en pacientes que presenten:
◦ ALT ≥5 veces el límite superior de la normalidad durante el tratamiento con remdesivir. Se puede reanudar el tratamiento con remdesivir cuando la ALT sea <5 veces el límite superior de la normalidad.
◦ Elevación de la ALT junto con signos o síntomas de inflamación hepática o aumento de la bilirrubina conjugada, la fosfatasa alcalina o el índice internacional normalizado (IIN) (ver secciones 4.8 y 5.2).
Insuficiencia renal
En los estudios en animales, en ratas y monos, se observó toxicidad renal grave (ver sección 5.3). El mecanismo de esta toxicidad renal no se conoce totalmente. No se puede descartar su relevancia en los seres humanos.
4.5 Interacción con otros medicamentos y otras formas de interacción
No se han realizado estudios clínicos de interacciones con remdesivir. Actualmente se desconoce el potencial general de interacciones; los pacientes deben permanecer bajo una estrecha observación durante los días de la administración de remdesivir.
No se ha estudiado el potencial de interacción de remdesivir con inhibidores/inductores de la vía hidrolítica (esterasa) o CYP2C8, 2D6 o 3A4. Se desconoce el riesgo de interacción clínicamente relevante. Los inhibidores potentes pueden provocar un aumento de la exposición a remdesivir. El uso de inductores potentes (p. ej., rifampicina) puede reducir las concentraciones plasmáticas de remdesivir y no se recomienda.
Tabla 2: Lista tabulada de reacciones adversas
Frecuentes y muy frecuentes:
- Trastornos cardíacos
- Trastornos hepatobiliares
- Lesiones traumáticas, intoxicaciones y complicaciones de procedimientos terapéuticos
Pacientes pediátricos
No se ha evaluado la farmacocinética en pacientes pediátricos.
Insuficiencia renal
No se ha evaluado la farmacocinética de remdesivir y GS-441524 en insuficiencia renal. Remdesivir no se elimina inalterado en orina de forma considerable, pero su metabolito principal GS-441524 se elimina por vía renal y las concentraciones de metabolitos en plasma pueden aumentar teóricamente en pacientes con insuficiencia renal. El excipiente bedatex sulfobutileter de sodio se elimina por vía renal y se acumula en pacientes con función renal disminuida. No se debe utilizar Veklury en pacientes con una TFGe <30 ml/min.
Insuficiencia hepática
No se ha evaluado la farmacocinética de remdesivir y GS-441524 en insuficiencia hepática. Se desconoce la función del hígado en el metabolismo de remdesivir.
Interacciones
No se estudió el potencial de interacción de remdesivir como víctima con respecto a la inhibición de la vía hidrolítica (esterasa). Se desconoce el riesgo de interacción clínicamente relevante.
5.3 Datos preclínicos sobre seguridad
Toxicología
Tras la administración intravenosa (bolo lento) de remdesivir a monos Rhesus y ratas, se produjo toxicidad renal grave después de tratamientos de corta duración. En monos Rhesus machos a niveles de dosis de 5, 10 y 20 mg/kg/día durante 7 días dio como resultado, en todos los niveles de dosis, un aumento en el nitrógeno ureico medio y un aumento en la creatinina media, atrofia tubular renal y basofilia y cilindros, y la muerte imprevista de un animal a un nivel de dosis de 20 mg/kg/día
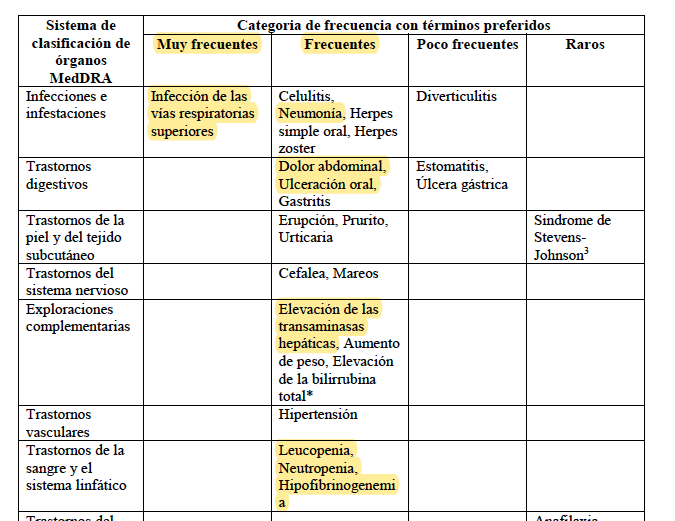
Tocilizumab (RoActemra)
Ver ficha técnica del producto
Tozilizumab (Actemra ® ) es un un costoso medicamento para la artritis reumatoide de la farmacéutica Roche del que aún no hay evidencia sobre su seguridad y eficacia y según el laboratorio indica, sus efectos secundarios frecuentes o muy frecuentes son «infección en vías respiratorias, neumonía, dolor abdominal, ulceración oral» entre otros.
RoActemra está indicado, en combinación con metotrexato (MTX), para:
• el tratamiento de artritis reumatoide (AR) grave, activa y progresiva en adultos no tratados previamente con MTX.
• el tratamiento de la AR activa
_________________________________________________
No se han evaluado dosis por encima de 1,2 g en estudios clínicos (ver sección 5.1)
_________________________________________________
Insuficiencia hepática: No se ha estudiado RoActemra en pacientes con insuficiencia hepática. Por tanto, no pueden hacerse recomendaciones sobre la dosis.
_________________________________________________
4.3 Contraindicaciones
Infecciones graves y activas (ver sección 4.4).
_________________________________________________
4.4 Advertencias y precauciones especiales de empleo
Infecciones
Se han notificado infecciones graves y en algunos casos mortales en pacientes que reciben agentes inmunosupresores incluido RoActemra (ver sección 4.8 Reacciones adversas). No debe iniciarse el tratamiento con RoActemra en pacientes con infecciones activas (ver sección 4.3). Se debe interrumpir la administración de RoActemra si un paciente desarrolla una infección grave, hasta que la infección esté controlada (ver sección 4.8). Los profesionales sanitarios deben tener precaución cuando consideren el uso de RoActemra en pacientes con un historial de infecciones recurrentes o crónicas o con procesos subyacentes (p. ej., diverticulitis, diabetes y enfermedad pulmonar intersticial) que puedan predisponer a los pacientes a infecciones.
_________________________________________________
Reactivación viral
Se ha notificado reactivación viral (por ejemplo, virus de la hepatitis B) en pacientes con AR que estaban en tratamiento con terapias biológicas. En los ensayos clínicos con tocilizumab, se excluyeron los pacientes con screening positivo para hepatitis.
_________________________________________________
Reacciones de hipersensibilidad
Se han notificado reacciones de hipersensibilidad graves asociadas a la perfusión de RoActemra (ver sección 4.8). Estas reacciones pueden ser más graves y potencialmente mortales en pacientes que han experimentado reacciones de hipersensibilidad durante perfusiones previas, incluso si han recibido premedicación con esteroides y antihistamínicos.
_________________________________________________
Se han observado casos graves de daño hepático, incluyendo fallo hepático agudo, hepatitis e ictericia con RoActemra (ver sección 4.8).
_________________________________________________
No se recomienda iniciar el tratamiento, en pacientes que no han sido tratados previamente con RoActemra, si el recuento absoluto de neutrófilos está por debajo de 2 x 109/l. Debe tenerse precaución al valorar el inicio del tratamiento con RoActemra en pacientes con un recuento bajo de plaquetas (es decir, recuento de plaquetas por debajo de 100 x 103/μl). No se recomienda continuar el tratamiento en pacientes que desarrollen un recuento absoluto de neutrófilos < 0,5 x 109/l o un recuento de plaquetas < 50 x 103/μl.
_________________________________________________
Embarazo
No hay datos suficientes acerca del uso de tocilizumab en mujeres embarazadas. Un estudio en animales ha mostrado un aumento del riesgo de aborto espontáneo / muerte embriofetal a una dosis alta (ver sección 5.3).
_________________________________________________
4.8 Reacciones adversas
Muy frecuentes: Infección de las vías respiratorias superiores
Frecuentes: Neumonía
_________________________________________________
Enfermedad Pulmonar Intersticial
El deterioro de la función pulmonar puede aumentar el riesgo de desarrollo de infecciones. Durante la comercialización se han notificado casos de enfermedad pulmonar intersticial (incluyendo neumonía, y fibrosis pulmonar) alguno de los cuales fue mortal.
BARITICINIB
Baricitinib (Olumiant ®) otro fármaco anteriormente prescrito para la artritis reumatoide, según indica vademecum.es en sus advertencias, causa aumento en el riesgo de Infecciones, no se recomienda en pacientes con infecciones activas y aumenta el riesgo de reactivación viral, entre otros efectos adversos. Estos datos son de claro acceso público.
Baricitinib

Fentanilo
Ver ficha tecnica del producto
4.4. Advertencias y precauciones especiales de empleo
Estado de las personas que no han recibido antes opioides y las que no los toleran
El uso de fentanilo en pacientes que no hayan recibido opioides anteriormente se ha asociado a casos muy poco frecuentes de depresión respiratoria significativa o mortalidad cuando se usa como terapia de opioides inicial, especialmente en pacientes con dolor sin cáncer. Existe el riesgo de hipoventilación grave o mortal, aunque se utilice la menor dosis de fentanilo al iniciar la terapia en pacientes que no hayan recibido opioides anteriormente, sobre todo en pacientes de mayor edad o con deficiencia hepática o renal. La tendencia del desarrollo a la tolerancia varía ampliamente entre las personas. Se recomienda que fentanilo se use en pacientes que hayan demostrado tolerancia a los opioides (ver sección 4.2).
Depresión respiratoria
Como ocurre con todos los opioides potentes, es posible que algunos pacientes experimenten una depresión respiratoria significativa con fentanilo; deben vigilarse estos efectos en los pacientes. Es posible que la depresión respiratoria persista tras la retirada del parche.
Enfermedad pulmonar crónica
Fentanilo puede tener efectos adversos más graves en pacientes con enfermedad pulmonar obstructiva crónica u otras enfermedades pulmonares.
Enfermedad cardíaca
Fentanilo puede producir bradicardia y, en consecuencia, debe administrarse con precaución a pacientes con bradiarritmias.
Hipotensión
Los opioides pueden provocar hipotensión, especialmente en pacientes con hipovolemia aguda.
Síndrome serotoninérgico
Existe la posibilidad de que se desarrolle el síndrome de la serotonina, que puede ser mortal, si se usan al mismo tiempo principios serotoninérgicos activos, como los inhibidores selectivos de recaptación de la serotonina (SSRI), inhibidores de recaptación de norepinefrina y serotonina (SNRI) y principios activos que afectan al metabolismo de la serotonina (incluidos los inhibidores de la monoamina oxidasa [MAOI]). Esto puede producirse con la dosis recomendada.
El síndrome de la serotonina puede incluir cambios en el estado mental (por ejemplo, excitación, alucinaciones, coma), inestabilidad autonómica (por ejemplo, taquicardias, presión arterial lábil, hipertermia), anormalidades neuromusculares (por ejemplo, hiperreflexia, descoordinación, rigidez) o síntomas gastrointestinales (por ejemplo, náuseas, vómitos, diarrea). Si se sospecha de síndrome de la serotonina, debe interrumpirse el tratamiento con fentanilo.
Propofol
Ver ficha técnica del producto
Insuficiencia cardíaca, circulatoria o pulmonar e hipovolemia
Como con otros agentes anestésicos intravenosos, en pacientes con insuficiencia cardiaca, respiratoria, renal o hepática o en pacientes debilitados o hipovolémicos propofol deberá administrarse con precaución.
Propofol no debe administrarse a pacientes con insuficiencia cardiaca avanzada.
Consejos referentes a la gestión en la Unidad de Cuidados Intensivos
El uso de perfusiones de emulsión de propofol para la sedación en cuidados intensivos se ha asociado con un conjunto de alteraciones metabólicas y fallos orgánicos sistémicos que pueden provocar la muerte. Se han notificado casos de combinaciones de los siguientes efectos: acidosis metabólica, rabdomiólisis, hiperkalemia, hepatomegalia, insuficiencia renal, hiperlipidemia, arritmia cardíaca, ECG tipo Brugada (elevación del segmento ST y curva T invertida) e insuficiencia cardíaca de rápida evolución que por lo general no responde a tratamiento de soporte con inotrópicos. Las combinaciones de estos acontecimientos se han denominado como síndrome de perfusión de propofol.
Los principales factores de riesgo para el desarrollo de estos eventos parecen ser los siguientes: disminución del oxígeno suministrado a los tejidos; lesiones neurológicas graves y/o sepsis; dosis elevadas de uno o varios de los siguientes agentes farmacológicos – vasoconstrictores, esteroides, fármacos inotrópicos y/o propofol (por lo general a dosis de propofol mayores de 4 mg/kg/h durante más de 48 horas).
El equipo médico deberá permanecer alerta ante estos acontecimientos y considerar una disminución de la dosis o la interrupción de la administración de propofol ante los primeros signos de aparición de los síntomas referidos anteriormente.
El uso concomitante de benzodiazepinas, agentes parasimpaticolíticos o anestésicos inhalatorios prolonga la anestesia y reduce el ritmo respiratorio.
Puede ocurrir bradicardia y parada cardíaca después del tratamiento con suxametonio o neostigmina.
Se ha descrito leucoencefalopatía con la administración de emulsiones lipídicas tales como propofol en pacientes tratados con ciclosporinas.
Morfina
Ver ficha técnica del producto
4.3. Contraindicaciones
Está contraindicado en:
– Pacientes con depresión respiratoria o enfermedad respiratoria obstructiva grave.
Riesgo de uso concomitante de medicamentos sedantes, como benzodiazepinas u otros medicamentos relacionados:
El uso concomitante de Morfina B. Braun 1 mg/ml solución inyectable y sedantes como benzodiazepinas u otros medicamentos relacionados puede producir sedación, depresión respiratoria, coma y la muerte. Debido a estos riesgos, la prescripción concomitante de estos medicamentos sedantes se debe reservar a los pacientes para los que no existan otras opciones alternativas de tratamiento.
4.8. Reacciones adversas
El perfil toxicológico de la morfina es similar al del resto de analgésicos opiáceos, aunque los efectos aparecen con más frecuencia. Los efectos adversos más característicos son:
– Poco frecuentes (>1/1000, <1/100):
Trastornos cardíacos: parada cardiaca, taquicardia y bradicardia, hipertensión, hipotensión, hipertensión intracraneal, colapso;
Entubado
Por otra parte, tenemos constancia de que se ha procedido a la sedación y la intubación indiscriminada de pacientes que presentaron insuficiencia respiratoria tras la administración de estos tóxicos.
Los neurólogos y los neurocientíficos de Massachusetts General Hospital en un estudio específico sobre los efectos de esa sedación prolongada en la función neurológica de los pacientes concluyeron con que algunos sedantes, como el PROPOFOL, pueden prolongar la anestesia y contribuir a que los pacientes no se despierten.
Otro estudio reciente publicado en el New England Journal of Medicine de Shibani Mukerji, MD, PhD, directora asociada de la Unidad de Enfermedades Neuro-Infecciosas de Mass General, muestra que los cerebros post-mortem de pacientes ventilados con el COVID-19 tienen una lesión hipóxica.
El ensayo ‘International Study to Understand the Impact and Best Practices of Airway Management in Critically Ill Patients’ (‘Intube’) , que contó con la participación de 2.964 pacientes de 29 países, lo que da muestra de su fortaleza estadística, realizado antes de la pandemia (entre octubre de 2018 y julio de 2019) pero con conclusiones que pueden aplicarse a los pacientes intubados por Covid, revela que el 45,2 por ciento de los pacientes sometidos a la intubación traqueal experimentan al menos un evento clínico mayor, y uno de cada tres (32,8 por ciento) muere en la UCI.
Artículo Pulmonary Barotrauma in COVID-19 Patients With ARDS on Invasive and Non-Invasive Positive Pressure Ventilation publicado en el Journal of Intensive Care Medicine en 2021.
*A estos protocolos que han acabado con la vida de cientos de miles de personas debemos sumar dos factores claves: La retirada total de la alimentación tras el ingreso en UCI y el aislamiento y la incomunicación, hechos agravantes y tortuosos para los pacientes.
Efectos adversos del entubado
Un estudio multicéntrico internacional liderado por Vincenzo Russotto, de la Escuela de Medicina y Cirugía de la Universidad de Milano-Bicocca (Italia), revela que el 45,2 por ciento de los pacientes sometidos a este procedimiento experimentaron al menos un evento clínico mayor, y uno de cada tres (32,8 por ciento) murió en la UCI:
De entre los eventos clínicos, el principal fue la inestabilidad cardiovascular, presente en el 42,6 por ciento de los pacientes. El siguiente más común fue la hipoxemia severa (9,3 por ciento) y, después, el paro cardiaco (3,1 por ciento).
El estudio sobre los eventos adversos tras la intubación traqueal ha sido publicado en JAMA y concluye que “los eventos cardiopulmonares ocurrieron con frecuencia”.
El ensayo ‘International Study to Understand the Impact and Best Practices of Airway Management in Critically Ill Patients’ (‘Intube’) fue realizado antes de la pandemia (entre octubre de 2018 y julio de 2019), pero sus conclusiones pueden aplicarse a los pacientes intubados por Covid.
Además, contó con la participación de 2.964 pacientes de 29 países, lo que da muestra de su fortaleza estadística.

Fuente original: https://www.elhospital.com/temas/Riesgos-y-complicaciones-de-la-ventilacion-mecanica+8054960
Dejamos un fragmento extraído de elhospital.com referente a LOS RIESGOS Y COMPLICACIONES DE LA VENTILACIÓN MECÁNICA, donde nos indica que la lesión pulmonar inducida por el ventilador representa un porcentaje importante de las complicaciones respiratorias de los pacientes en la UCI:
La ventilación mecánica somete inevitablemente al pulmón a un potencial daño físico, conocido como “lesión pulmonar inducida por ventilador” (LPIV), la cual representa un porcentaje importante de las complicaciones respiratorias de los pacientes en las unidades de cuidados intensivos.
Se han propuesto dos factores que contribuyen a su desarrollo. El primero es un daño físico por sobredistensión, principalmente visto en pulmones con lesiones heterogéneas, donde las áreas sanas son propensas a mayor insuflación al aplicar ventilación con presión positiva. Este tipo de daño se caracteriza por importante inflamación tisular, edema, formación de membranas hialinas y liberación de mediadores inflamatorios a la circulación. El segundo factor propuesto es la apertura y el cierre repetido de alvéolos atelectásicos en el pulmón lesionado.
Además del daño a nivel tisular (alveolar), la ventilación mecánica también se ha asociado con disfunción diafragmática inducida en las primeras 24 a 48 horas, por la supresión de la actividad espontánea normal de los músculos de la respiración, la cual altera el flujo sanguíneo y el tiempo de reposo del músculo, y causa cambios celulares importantes, como atrofia, pérdida miofibrilar, proteólisis, formación de vacuolas y alteración en las mitocondrias (…)
Mórfico y éxitus
Iatrogenia en las residencias de ancianos (primera ola)

No se podía derivar a los mayores de 70 años. La orden nos la dieron de la dirección”, relata C. R., y añade: “No se ocultaba. Llamaban de una casa porque un anciano se había puesto malito. Iba el médico. Si veía que era covid-19, les decía a las familias que no se le podía llevar al hospital, porque estaban llenos, y que tenía que quedarse en casa”.
A partir de ese momento, antibióticos y paracetamol. Y, si el enfermo no salía adelante por sí mismo, a los sanitarios ya no les quedaba otra posibilidad que la sedación, ya viviera el enfermo en una residencia o en su casa
https://www.elperiodico.com/es/sociedad/20200626/sedacion-coronavirus-ancianos-8014623
Más información sobre los protocolos en residencias de ancianos: https://periodistasporlaverdad.com/residencias-de-ancianos-vacunacion-abandono-morfico-y-exitus/
Ejemplo de Protocolos: Hospital LA FE de Valencia
Recopilamos información sobre los protocolos y tratamientos que están recibiendo los ingresados por COVID en los hospitales de España, recomendados por el Ministerio de Sanidad.
Nos centramos en el protocolo farmacológico del hospital «La Fe» de Valencia para los enfermos ingresado en plantas COVID. En relación al cuadro clínico el protocolo varía, los enfermos más graves reciben los fármacos más tóxicos. Tenemos constancia de que durante los primeros meses, se administró a los enfermos Lopinavir / Ritonavir (Kaletra®), fármaco anteriormente administrado a enfermos de VIH y después recomendado por la OMS para el tratamiento de la enfermedad COVID.
Entre los efectos secundarios del antiretroviral Lopinavir / Ritonavir (Kaletra®) encontramos: riesgo de reacciones adversas hepáticas graves y potencialmente mortales , respuesta inflamatoria con cuadros clínicos graves, casos de pancreatitis en ocasiones fatales, convulsiones, letargo, taquicardia, hiperosmolaridad, hemólisis y casos potencialmente mortales de toxicidad cardiaca, acidosis láctica e insuficiencia renal aguda.
Resulta curioso observar como Kaletra®, seguía apareciendo a 15/02/21 en la web oficial del Ministerio de Sanidad mientras que la OMS en un comunicado de prensa a 4 de Julio de 2020, anunció meses antes la interrupción de los grupos de tratamiento con este medicamento.
Protocolos
- Lopinavir- Ritonavir (Kaletra) : Un tóxico que puede provocar toxicidad hepática mortal, respuesta inflamatoria grave, casos potencialmente mortales de toxicidad cardiaca, acidosis láctica, insuficiencia renal aguda e infecciones, administrado a los más ancianos y débiles con supuesto COVID.
- Entubado o Ventilación mecánica: El estudio multicéntrico internacional de la Escuela de Medicina y Cirugía de la Universidad de Milano-Bicocca (Italia), revela que el 45,2 por ciento de los pacientes sometidos a este procedimiento experimentaron al menos un evento clínico mayor, y uno de cada tres (32,8 por ciento) murió en la UCI
- Propofol y otros mórficos Según el informe sobre Efectos neurolóficos de la sedación en los pacientes COVID-19 | Informe del Massachusetts General Hospital: La sedación a largo plazo para los pacientes con el COVID-19 se relaciona con la lesión hipóxica.
- Remuneración a los hospitales en Cataluña por cada Ingreso UCI COVID: 43.400€ + Muerte COVID: 5000€. BOE-A-2020-5649
- Remuneración extra por PCR realizada: 93€. BOE-A-2020-5649