Tradicionalmente, los médicos no realizan pruebas de virus respiratorios porque las pruebas no informan el tratamiento del paciente. En el caso de las pruebas de PCR generalizadas observadas durante la pandemia de Covid-19, los resultados deben evaluarse en el contexto de los síntomas clínicos y la posible exposición.
Desde el comienzo del brote de SARS-CoV-2 a principios de 2020 e incluida en las pautas de la Organización Mundial de la Salud que instan a los gobiernos a “probar, probar, probar” como parte de su estrategia de contención y rastreo de contactos, la prueba PCR se promovió como la “prueba de oro”. estándar” de detección de COVID-19.
Casos de COVID-19 confirmados solo con prueba diagnóstica
El primer paso en la investigación de cualquier brote de enfermedad es crear una definición de caso. Los epidemiólogos definen los criterios uniformes que clasifican un caso confirmado de una enfermedad para la vigilancia de la salud pública. Una definición clara y concisa es esencial al decidir qué medir en términos de frecuencia y gravedad de la enfermedad. Las definiciones de casos de enfermedades transmisibles deben contener tanto síntomas clínicos como pruebas de laboratorio confirmatorias [1]. Un ejemplo de una definición de caso para influenza es: una persona que cumple con los criterios de enfermedad similar a la influenza (ILI) de fiebre (≥100.4℉) y tos y/o dolor de garganta y tiene un cultivo positivo o una prueba de RT-PCR para influenza de un muestra respiratoria.
En abril de 2020, el Consejo de Epidemiólogos Estatales y Territoriales (CSTE) emitió una declaración de posición provisional para la definición de caso de COVID-19 [2]. COVID-19 se convirtió en la primera enfermedad transmisible para la que no se requerían signos o síntomas clínicos para la clasificación: un caso se confirmaba si “cumple con la evidencia de laboratorio confirmatoria”. La evidencia de laboratorio confirmatoria fue “detección de ARN del SARS-CoV-2 en una muestra clínica mediante una prueba de detección de amplificación molecular”. La prueba de diagnóstico aprobada para COVID-19 fue la reacción en cadena de la polimerasa cuantitativa o en tiempo real (RT-PCR), una tecnología utilizada para estimar la cantidad de copias de una secuencia de ADN específica en una muestra en tiempo real.
¿Qué es la reacción en cadena de la polimerasa (PCR)?
Los virus son simplemente material genético, ya sea ADN o ARN, rodeado de proteína. Hay varios cientos de virus que pueden causar enfermedades respiratorias en humanos. En la mayoría de los casos, los médicos no realizan pruebas para detectar virus respiratorios. Antes de la década de 1980, los métodos de análisis se basaban en el cultivo y la serología (suero sanguíneo). Un cultivo típico no podía hacer crecer más de setenta de los virus respiratorios que infectan a los humanos, y siempre era un método largo, subjetivo e insensible para aquellos virus que podían crecer. Después de la década de 1980, una técnica llamada reacción en cadena de la polimerasa (PCR) se convirtió en el estándar de oro para las pruebas de infección viral.
La PCR fue inventada por el Dr. Kary Mullis en 1984 durante un viaje a la luz de la luna por las montañas de California [3]. La PCR es una técnica que aprovecha el poder de la replicación del ADN, un proceso biológico básico en las células. Es una técnica poderosa, muy sensible y altamente específica, que se usa en medicina forense e investigación porque se requieren muy pocas copias de una secuencia genética en el material de partida para la detección. Esta técnica utiliza ADN polimerasa y fragmentos sintéticos de ADN para amplificar una región específica de una secuencia de ADN objetivo in vitro , que luego se convierte en parte de otras reacciones [4]. Cada ronda de replicación aumenta exponencialmente la región de interés, duplicando el producto con cada ciclo hasta que se puede detectar.
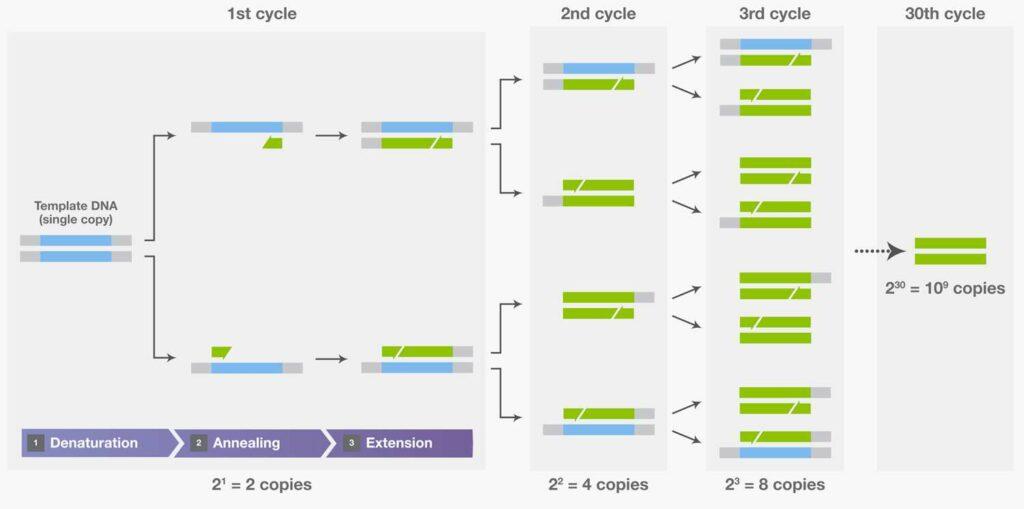
Tres pasos de PCR, desnaturalización, hibridación y extensión, como se muestra en el primer ciclo, y la amplificación exponencial del ADN objetivo con ciclos repetidos. Fuente de imagen
En la PCR estándar, el material amplificado se detecta separando la mezcla mediante electroforesis en gel, un método de laboratorio utilizado para separar mezclas de ADN, ARN o proteínas según el tamaño molecular. Sin embargo, con la PCR cuantitativa, los productos de la reacción se pueden controlar en tiempo real mediante marcaje fluorescente. Esto permite la recopilación de datos a medida que avanza cada ciclo. La señal de fluorescencia aumenta proporcionalmente a la cantidad de ADN replicado. Por lo tanto, el ADN se cuantifica en “tiempo real”.
La línea de umbral es el nivel de detección o el punto en el que una reacción alcanza una intensidad fluorescente por encima del fondo. El ciclo en el que la muestra alcanza este nivel se denomina umbral de ciclo (Ct). El valor de Ct es inversamente proporcional a la cantidad de material de partida. Esto significa que cuanto mayor sea el valor de Ct, menor será el número de copias en el material de partida; por el contrario, un valor de Ct más bajo indicaría un mayor número de copias en el material de partida. Cuando se utiliza PCR en tiempo real para la detección de virus, esto significaría que hay menos virus presentes cuando el valor de Ct es más alto porque se necesitan más ciclos para detectar el objetivo dado. Por lo tanto, los valores de Ct pueden dar una indicación de dónde puede estar una persona en el ciclo infeccioso. Sin embargo, solo porque la prueba detecta el genoma viral,
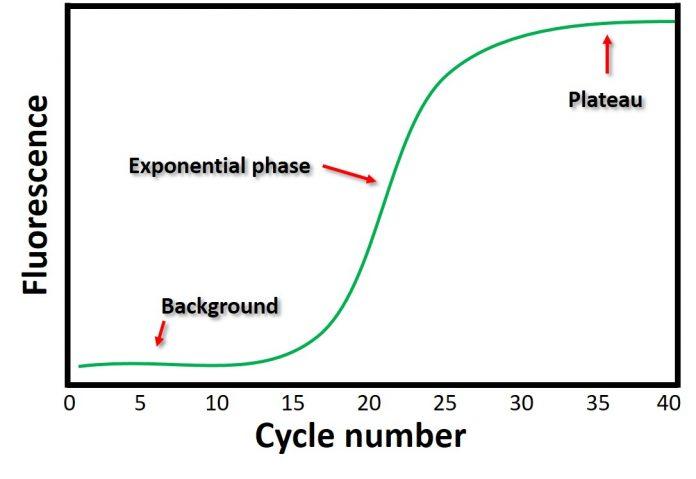
El gráfico se asemeja a un patrón de amplificación sigmoidal, como lo indica la línea verde. Esta línea verde demuestra el cambio en la fluorescencia durante el número de ciclos. Por lo general, en un experimento de qPCR, hay 40 ciclos. Eso es 40 rondas de amplificación. Fuente de imagen
Muchas de las plataformas de PCR que se utilizan para la detección del SARS-CoV-2 habían establecido un valor Ct de cuarenta (también recomendado por los CDC) como valor de corte para una prueba positiva, de un total de cuarenta y cinco ciclos. A valores altos de Ct (más de treinta), generalmente hay una unión no específica debido a una serie de cosas (dímeros de cebadores, contaminantes ambientales, etc.) [5]. Además, según el tipo de sistema de detección, los tintes fluorescentes se unirán a cualquier ADN de doble cadena en el tubo de reacción [6]. Este tipo de reacciones se considerarían falsos positivos: con resultado positivo en personas que no son ni infecciosas ni contagiosas.
Los valores de Ct no deben usarse para informar la política de salud pública.
Ahora hay suficiente evidencia en términos de datos publicados que muestran que los valores de corte de Ct usados para determinar un ‘caso’ eran demasiado altos. Es decir, es posible que los resultados positivos no hayan sido significativos y que la persona haya superado la etapa transmisible de la infección. El cultivo viral es la referencia contra la cual se debe medir y calibrar cualquier prueba de índice de diagnóstico para virus, para comprender las propiedades predictivas de esa prueba. El CDC señaló que el virus infeccioso ya no se detecta 8 días después de la infección. El pico de replicación del SARS-CoV-2 es alrededor del día 5 después de la infección y disminuye, hasta que ya no es detectable a través del cultivo el día 8 [7]. En términos de vigilancia, los valores altos de Ct pueden indicar una infección pasada, pero ciertamente no son indicativos de una infección actual. Se ha demostrado que las muestras con valores de Ct >30 no contienen virus cultivables (que se replican activamente). Un estudio de La Scola et. Alabama. correlacionó los valores de Ct obtenidos mediante la técnica RT-PCR basada en la amplificación del gen E del SARS-CoV-2 (Figura 1). Los resultados del cultivo muestran, “que a Ct = 25, hasta el 70% de los pacientes permanecieron positivos en cultivo y que a Ct = 30 este valor desciende al 20%. En Ct = 35, el valor que usamos para informar un resultado positivo para PCR, <3% de los cultivos son positivos [8] .”
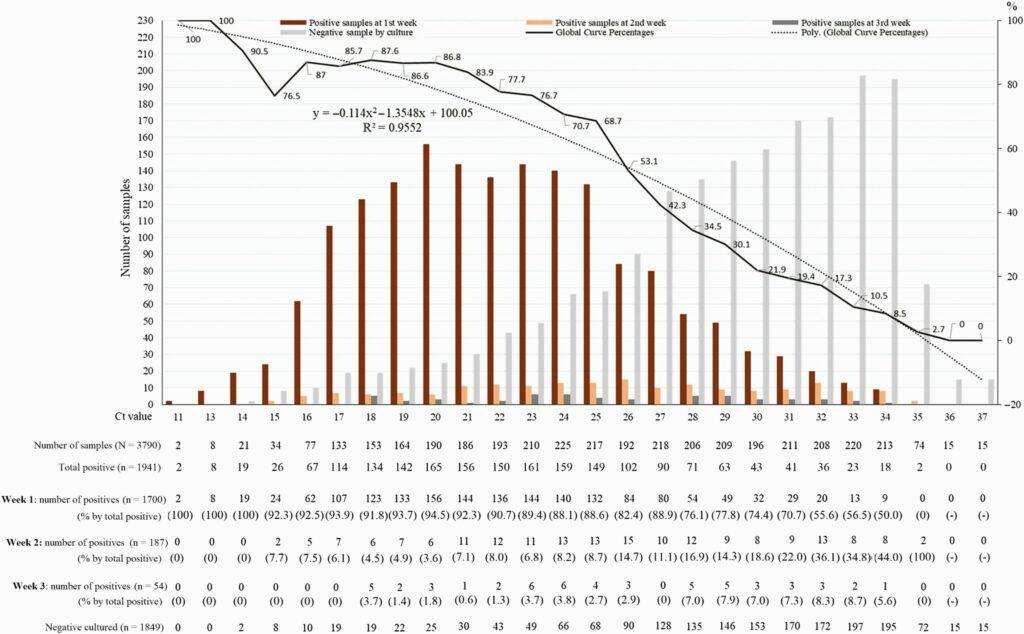
Porcentaje de cultivos virales positivos de muestras nasofaríngeas positivas para la reacción en cadena de la polimerasa por coronavirus 2 del síndrome respiratorio agudo severo de pacientes con enfermedad por coronavirus 2019, según valor de Ct (línea simple). La curva discontinua indica la curva de regresión polinomial. Abreviaturas: Ct, umbral del ciclo; Poli., polinomio. Fuente de imagen
Otro estudio investigó el cultivo viral en muestras de un grupo de pacientes y comparó los resultados con los datos de las pruebas de PCR y el momento de aparición de los síntomas [9]. Este estudio analizó noventa muestras positivas de RT-PCR utilizando cultivo celular. La infectividad de las células SARS-CoV-2 de muestras respiratorias de individuos positivos para SARS-CoV-2 solo se observó para RT-PCR con valores de Ct < 24 y el inicio de los síntomas a la prueba de < 8 días. La probabilidad de obtener un cultivo viral positivo alcanzó su punto máximo el día 3 y disminuyó a partir de ese momento. Por lo tanto, la infectividad de los pacientes con valores de Ct > 24 y duración de los síntomas > 8 días se consideró baja. También determinaron que por cada aumento de una unidad en el valor de Ct, las probabilidades de un cultivo positivo disminuyeron en un 36 %. Este estudio mostró que la probabilidad de infección por el virus SARS-CoV-2 es mayor cuando el umbral del ciclo es más bajo. Cuando los síntomas para el tiempo de prueba son más cortos y se confirman más allá de los 8 días, no se detecta ningún virus vivo.
Otro estudio publicado en agosto de 2020 analizó muestras de los primeros 3 meses de la pandemia de COVID-19 en el Reino Unido: finales de enero a principios de abril de 2020 [10]. Usando los valores del umbral del ciclo (Ct) de RT-PCR como una medida semicuantitativa de la carga viral del SARS-CoV-2, encontraron que el nivel de ARN del SARS-CoV-2 en el tracto respiratorio superior fue mayor alrededor del inicio de los síntomas, disminuyó constantemente durante el primeros 10 días después del inicio de la enfermedad y luego se estabilizó. Se intentó el cultivo de virus a partir de 324 muestras, extraídas de 253 casos que dieron positivo para SARS-CoV-2 por RT-PCR. Observaron una fuerte relación entre el valor de Ct y la capacidad de recuperar virus infecciosos. La razón de probabilidades (OR) estimada de recuperar el virus infeccioso disminuyó en 0,67 por cada unidad de aumento en el valor de Ct (IC del 95 %: 0,58–0,77). La detección del virus cultivable alcanzó su punto máximo alrededor del momento del inicio de los síntomas, con una duración media de 4 días de excreción del virus medido por cultivo. Llegaron a la conclusión de que el uso de valores de Ct proporciona un valioso proxy para la detección de virus infecciosos y puede ayudar a informar la toma de decisiones sobre el control de infecciones.
Conclusión
Tradicionalmente, los médicos no realizan pruebas de virus respiratorios porque las pruebas no informan el tratamiento del paciente.En otras palabras, la prueba de infección por virus respiratorio no cambiaría la forma en que un médico trataría a una persona, ya que el tratamiento se basaría en los síntomas y en su mayoría sería de apoyo. Las pruebas de influenza se realizan de forma rutinaria porque es el único virus respiratorio para el cual existe un tratamiento antiviral aprobado. Como el SARS-CoV-2 no se asoció con una constelación de síntomas específicos, y se sospechó que las personas sin síntomas estaban infectadas, la confirmación de un caso se basó únicamente en los resultados de una prueba molecular. Esta es la primera enfermedad transmisible por la cual una persona sin signos o síntomas de enfermedad puede clasificarse como caso confirmado. Un caso confirmado basado únicamente en una prueba molecular significa que se debe realizar la debida diligencia para garantizar la clasificación adecuada de cada caso. La detección de algún trozo de material genético no indica si un individuo es infeccioso o contagioso. Esto significa que se requieren más detalles para el resultado positivo.
El alto número de personas que dieron positivo sin síntomas indicó que los resultados positivos de la PCR no eran significativos para el diagnóstico y que los pacientes podrían haber superado la etapa transmisible de la infección. El uso generalizado de las pruebas de PCR distorsionó y corrompió en gran medida los datos sobre las tasas de infección y mortalidad por SARS-CoV-2. El mensaje para llevar a casa es que los resultados de las pruebas de PCR deben evaluarse en el contexto de los síntomas clínicos y la posible exposición. Bajo ninguna circunstancia se debe utilizar la prueba PCR como una herramienta de vigilancia amplia, o un indicador de prevalencia de infección, o para evaluar la causa de muerte. Además, los resultados de las pruebas de PCR nunca deben ser una justificación para imponer medidas, mitigaciones o restricciones a nivel de población.
Referencias
- https://www.cdc.gov/csels/dsepd/ss1978/lesson1/section5.html
- https://cdn.ymaws.com/www.cste.org/resource/resmgr/2020ps/interim-20-ID-01_COVID-19.pdf
- https://www.sciencedirect.com/science/article/abs/pii/0076687987550236
- https://assets.publishing.service.gov.uk/government/uploads/system/uploads/attachment_data/file/926410/Understanding_Cycle_Threshold__Ct__in_SARS-CoV-2_RT-PCR_.pdf
- https://www.bio-rad.com/en-us/applications-technologies/pcr-troubleshooting?ID=LUSO3HC4S
- https://www.gene-quantification.de/chemistry.html
- https://academic.oup.com/cid/article/71/10/2663/5842165
- https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7185831/
- https://www.cebm.net/study/predicting-infectious-sars-cov-2-from-diagnostic-samples/
- https://www.eurosurveillance.org/content/10.2807/1560-7917.ES.2020.25.32.2001483#html_fulltext
Este artículo fue publicado originalmente en https://pandata-org. Lea el original.
